Chiropraticien basé sur la science Dr. Alexander Jimenez jette un coup d'oeil à stress oxydatif, qu'est-ce que c'est, comment cela affecte le corps et la défense antioxydante pour remédier à la situation.
Esra Birben Ph.D., 1 Umit Murat Sahiner MD, 1 Cansin Sackesen MD, 1 Serpil Erzurum MD, 2 et Omer Kalayci, MD1
Résumé: Les espèces réactives de l'oxygène (ROS) sont produites par des organismes vivants à la suite d'un métabolisme cellulaire normal et de facteurs environnementaux, tels que les polluants atmosphériques ou la fumée de cigarette. Les ROS sont des molécules hautement réactives et peuvent endommager les structures cellulaires telles que les hydrates de carbone, les acides nucléiques, les lipides et les protéines et modifier leurs fonctions. Le changement d'équilibre entre les oxydants et les antioxydants en faveur des oxydants est appelé «stress oxydatif». La régulation de l'état réducteur et oxydant (redox) est critique pour la viabilité cellulaire, l'activation, la prolifération et la fonction des organes. Les organismes aérobies ont des systèmes antioxydants intégrés, qui comprennent des antioxydants enzymatiques et non enzymatiques qui sont habituellement efficaces pour bloquer les effets nocifs des ROS. Cependant, dans des conditions pathologiques, les systèmes antioxydants peuvent être débordés. Le stress oxydatif contribue à de nombreuses pathologies et pathologies, notamment le cancer, les troubles neurologiques, l'athérosclérose, l'hypertension, l'ischémie / perfusion, le diabète, le syndrome de détresse respiratoire aiguë, la fibrose pulmonaire idiopathique, la bronchopneumopathie chronique obstructive et l'asthme. Dans cette revue, nous résumons les systèmes oxydants et antioxydants cellulaires et discutons les effets cellulaires et les mécanismes du stress oxydatif.
Mots-clés: antioxydant, oxydant, stress oxydatif, espèces réactives de l'oxygène, redox
(Journal WAO 2012; 5: 9-19)
Les espèces réactives de l'oxygène (ROS) sont produites par des organismes vivants à la suite d'un métabolisme cellulaire normal. À des concentrations faibles à modérées, ils fonctionnent dans les processus cellulaires physiologiques, mais à des concentrations élevées, ils produisent des modifications néfastes des composants cellulaires, tels que les lipides, les protéines et l'ADN.1–6 Le changement d'équilibre entre oxydant / antioxydant en faveur des oxydants est appelé «stress oxydatif». Le stress oxydatif contribue à de nombreuses conditions pathologiques, notamment le cancer, les troubles neurologiques, l'athérosclérose 7–10, l'hypertension, l'ischémie / perfusion, le diabète 11–14, le syndrome de détresse respiratoire aiguë, la fibrose pulmonaire idiopathique, la maladie pulmonaire obstructive chronique15 et l'asthme16– 21 Les organismes aérobies ont des systèmes antioxydants intégrés, qui comprennent des antioxydants enzymatiques et non enzymatiques qui sont généralement efficaces pour bloquer les effets nocifs des ROS. Cependant, dans des conditions pathologiques, les systèmes antioxydants peuvent être dépassés. Dans cette revue, nous résumons les systèmes cellulaires oxydants et antioxydants et la régulation de l'état réducteur et oxydant (redox) dans les états de santé et de maladie.
Table des matières
OXYDANTS
Sources endogènes de ROS
Les ROS sont produits à partir d'oxygène moléculaire à la suite du métabolisme cellulaire normal. Les ROS peuvent être divisés en groupes 2: radicaux libres et nonradicaux. Les molécules contenant un ou plusieurs électrons non appariés et donnant ainsi une réactivité à la molécule sont appelées radicaux libres. Lorsque les radicaux libres 2 partagent leurs électrons non appariés, des formes non radiales sont créées. Les ROS majeurs de 3 qui ont une signification physiologique sont l'anion superoxyde (O22.), Le radical hydroxyle (OH) et le peroxyde d'hydrogène (H2O2). Les ROS sont résumés dans le tableau 1.
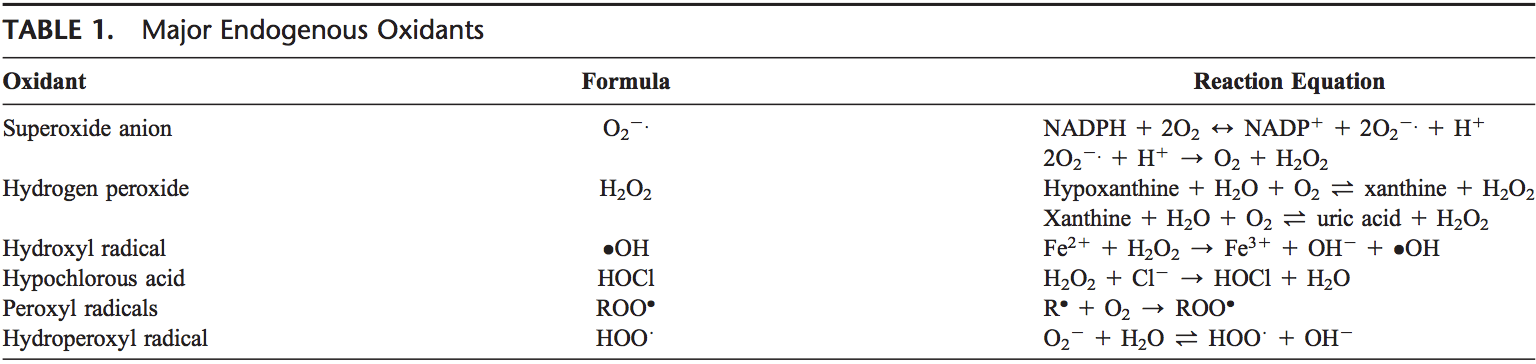 L'anion superoxyde est formé par l'addition d'un électron à l'oxygène moléculaire.1 Ce processus est médié par la nicotine adénine dinucléotide phosphate [NAD (P) H] oxydase ou la xanthine oxydase ou par le système de transport d'électrons mitochondrial. Le site principal de production d'anion superoxyde est la mitochondrie, le mécanisme de la cellule pour produire l'adénosine triphosphate. Normalement, les électrons sont transférés à travers la chaîne de transport d'électrons mitochondriale pour réduire l'oxygène en eau, mais environ 22 à 1% de tous les électrons fuient du système et produisent du superoxyde. La NAD (P) H oxydase se trouve dans les leucocytes polymorphonucléaires, les monocytes et les macrophages. Lors de la phagocytose, ces cellules produisent une explosion de superoxyde qui conduit à une activité bactéricide. Le superoxyde est transformé en peroxyde d'hydrogène par l'action de superoxyde dismutases (SOD, EC 3). Le peroxyde d'hydrogène diffuse facilement à travers la membrane plasmique. Le peroxyde d'hydrogène est également produit par la xanthine oxydase, l'acide aminé oxydase et la NAD (P) H oxydase 1.15.1.1 et dans les peroxysomes par la consommation d'oxygène moléculaire dans les réactions métaboliques. Dans une succession de réactions appelées réactions Haber – Weiss et Fenton, H23,24O2 peut se décomposer en OH2 en présence de métaux de transmission comme Fe2 ou Cu21
L'anion superoxyde est formé par l'addition d'un électron à l'oxygène moléculaire.1 Ce processus est médié par la nicotine adénine dinucléotide phosphate [NAD (P) H] oxydase ou la xanthine oxydase ou par le système de transport d'électrons mitochondrial. Le site principal de production d'anion superoxyde est la mitochondrie, le mécanisme de la cellule pour produire l'adénosine triphosphate. Normalement, les électrons sont transférés à travers la chaîne de transport d'électrons mitochondriale pour réduire l'oxygène en eau, mais environ 22 à 1% de tous les électrons fuient du système et produisent du superoxyde. La NAD (P) H oxydase se trouve dans les leucocytes polymorphonucléaires, les monocytes et les macrophages. Lors de la phagocytose, ces cellules produisent une explosion de superoxyde qui conduit à une activité bactéricide. Le superoxyde est transformé en peroxyde d'hydrogène par l'action de superoxyde dismutases (SOD, EC 3). Le peroxyde d'hydrogène diffuse facilement à travers la membrane plasmique. Le peroxyde d'hydrogène est également produit par la xanthine oxydase, l'acide aminé oxydase et la NAD (P) H oxydase 1.15.1.1 et dans les peroxysomes par la consommation d'oxygène moléculaire dans les réactions métaboliques. Dans une succession de réactions appelées réactions Haber – Weiss et Fenton, H23,24O2 peut se décomposer en OH2 en présence de métaux de transmission comme Fe2 ou Cu21
Fe31 + .O2 ?Fe2 + O2 Haber Weiss
Fe2 + H2O2 ?Fe3 + OH + .OH Réaction de Fenton
L'O 2 lui-même peut également réagir avec H2 O2 et générer OH .26,27 Le radical hydroxyle est le plus réactif des ROS et peut endommager les protéines, les lipides, les glucides et l'ADN. Il peut également démarrer la peroxydation lipidique en prenant un électron dans les acides gras polyinsaturés.
Les enzymes granulocytaires augmentent encore la réactivité de H2O2 via l'éosinophile peroxydase et la myéloperoxydase (MPO). Dans les neutrophiles activés, H2O2 est consommé par MPO. En présence d'ions chlorure, H2O2 est converti en acide hypochloreux (HOCl). Cependant, HOCl peut également réagir avec l'ADN et induire des interactions ADN-protéine et produire des produits d'oxydation de la pyrimidine et ajouter du chlorure aux bases de l'ADN.28 Eosinophil peroxidase et MPO contribuent également au stress oxydatif par modification des protéines par halogénation, nitration et réticulation protéique via les tyrosyles.29,30-31
D'autres radicaux libres dérivés de l'oxygène sont les radicaux peroxyles (ROO $). La forme la plus simple de ces radicaux est le radical hydro-peroxyle (HOO $) et joue un rôle dans la peroxydation des acides gras. Les radicaux libres peuvent déclencher des réactions en chaîne de peroxydation des lipides en extrayant un atome d'hydrogène d'un carbone de méthylène à chaîne latérale. Le radical lipidique réagit ensuite avec l'oxygène pour produire un radical peroxyle. Le radical peroxylique initie une réaction en chaîne et transforme les acides gras polyinsaturés en hydroperoxydes lipidiques. Les hydroperoxydes lipidiques sont très instables et se décomposent facilement en produits secondaires, tels que les aldéhydes (tels que 4-hydroxy-2,3-nonenal) et les malondialdéhydes (MDA). Les isoprostanes sont un autre groupe de produits de peroxydation lipidique qui sont générés par la peroxydation de l'acide arachidonique et se sont également révélés être élevés dans le plasma et les condensats respiratoires des asthmatiques.34,35 Peroxydation des lipides perturbe l'intégrité des membranes cellulaires et conduit à un réarrangement de la structure membranaire .
Le peroxyde d'hydrogène, le radical superoxyde, le glutathion oxydé (GSSG), les MDA, les isoprostanes, les carbonyles et la nitrotyrosine peuvent être facilement mesurés à partir d'échantillons de plasma, de sang ou de lavage broncho-alvéolaire comme biomarqueurs d'oxydation par des tests standardisés.
Source exogène d'oxydants
Fumée de cigarette
La fumée de cigarette contient de nombreux oxydants et radicaux libres et des composés organiques, tels que le superoxyde et l'oxyde nitrique.36 En outre, l'inhalation de fumée de cigarette dans les poumons active également certains mécanismes endogènes, tels que l'accumulation de neutrophiles et de macrophages. .
Exposition à l'ozone
L'exposition à l'ozone peut provoquer une peroxydation des lipides et induire un afflux de neutrophiles dans l'épithélium des voies respiratoires. L'exposition à court terme à l'ozone provoque également la libération de médiateurs inflammatoires, tels que MPO, protéines cationiques éosinophiles et aussi lactate déshydrogénase et albumine.37 Même chez les sujets sains, l'exposition à l'ozone entraîne une réduction des fonctions pulmonaires. 38 Cho et al39 ont montré que les particules (mélange de particules solides et de gouttelettes liquides en suspension dans l'air) catalysent la réduction de l'oxygène.
Hyperoxie
L'hyperoxie fait référence à des conditions de taux d'oxygène plus élevés que la pression partielle normale de l'oxygène dans les poumons ou d'autres tissus corporels. Il conduit à une plus grande production d'espèces réactives d'oxygène et d'azote.40,41
Rayonnement ionisant
Le rayonnement ionisant, en présence d'O2, convertit le radical hydroxyle, le superoxyde et les radicaux organiques en peroxyde d'hydrogène et en hydroperoxydes organiques. Ces espèces d'hydroperoxyde réagissent avec des ions métalliques redox actifs, tels que Fe et Cu, via des réactions de Fenton et induisent ainsi un stress oxydatif.42,43 Narayanan et al44 ont montré que les fibroblastes qui étaient exposés aux particules alpha présentaient des augmentations significatives de l'O2 2 intracellulaire. et la production de H2O2 par des molécules de transduction du signal NADPH oxydase.44 liées à la membrane plasmique, telles que les kinases 1 et 2 (ERK1 / 2) régulées par le signal extracellulaire, la kinase c-Jun N-terminale et les facteurs de transcription. tels que la protéine activatrice 38 (AP-1), le facteur nucléaire kB (NF-kB) et p1, sont activés, ce qui entraîne l'expression de gènes liés à la réponse au rayonnement.53-45 Ultraviolet A (UVA) déclencheur de photons réactions oxydatives par excitation de photosensibilisateurs endogènes, tels que les porphyrines, la NADPH oxydase et les riboflavines. 50-Oxo-8-dihydroguanine (7,8-oxoGua) est le principal produit d'oxydation de l'ADN médié par les UVA formé par l'oxydation du radical OH, les oxydants 8 et l'oxygène singulet qui réagit principalement avec la guanine.1 La formation du cation radical guanine Dans l'ADN isolé, l'effet direct des rayonnements ionisants a été démontré.51 Après une exposition aux rayonnements ionisants, le niveau intracellulaire de glutathion (GSH) diminue à court terme, mais augmente à nouveau.52,53
Ions de métaux lourds
Les ions de métaux lourds tels que le fer, le cuivre, le cadmium, le mercure, le nickel, le plomb et l'arsenic peuvent induire la formation de radicaux réactifs et causer des dommages cellulaires par épuisement des enzymes et par réaction avec les protéines nucléaires et l'ADN.
L'un des mécanismes les plus importants de la génération de radicaux libres à médiation par les métaux est une réaction de type Fenton. L'ion superoxyde et le peroxyde d'hydrogène peuvent interagir avec les métaux de transition, tels que le fer et le cuivre, via la réaction de Haber-Weiss / Fenton catalysée par un métal pour former des radicaux OH.
Metal31 1 $ O2 / Métal21 1 O2 Haber Weiss Métal21 1 H2 O2 / Métal31 1 OH 2 1 $ OH Réaction de Fenton
Outre les mécanismes de type Fenton et Haber-Weiss, certains ions métalliques peuvent réagir directement avec des molécules cellulaires pour générer des radicaux libres, tels que des radicaux thiols, ou induire des voies de signalisation cellulaire. Ces radicaux peuvent également réagir avec d'autres molécules de thiol pour générer O22 .. O22. est converti en H2O2, ce qui provoque une production supplémentaire de radicaux d'oxygène. Certains métaux, tels que l'arsénite, induisent la formation de ROS indirectement par l'activation de systèmes produisant des radicaux dans les cellules.56
L'arsenic est un élément hautement toxique qui produit une variété de ROS, y compris le superoxyde (O2 2), l'oxygène singulet (1O2), le radical peroxyle (ROO), le monoxyde d'azote (NO), le peroxyde d'hydrogène (H2O2) et les radicaux diméthylarsiniques peroxyle [( CH3) 2AsOO] .57-59 Les composés de l'arsenic (III) peuvent inhiber les enzymes antioxydantes, en particulier les enzymes GSH-dépendantes, telles que les glutathion-S-transférases (GST), la glutathion peroxydase (GSH-Px) et la GSH réductase - à leurs groupes sulfhydryle (-SH). 60,61
Le plomb augmente la peroxydation lipidique.62 Des diminutions significatives de l'activité de la SOD tissulaire et de la GPx cérébrale ont été rapportées après exposition au plomb.63,64 Le remplacement du zinc, qui sert de cofacteur pour de nombreuses enzymes par le plomb, entraîne l'inactivation de ces enzymes. L'exposition au plomb peut provoquer une inhibition de la GST en affectant les thiols tissulaires.
Les ROS générés par des réactions catalysées par des métaux peuvent modifier les bases de l'ADN. Trois substitutions de base, G / C, G / T et C / T, peuvent se produire à la suite de dommages oxydatifs par des ions métalliques, tels que Fe21, Cu21 et Ni21. Reid et al65 ont montré que G / C était principalement produit par Fe21 alors que la substitution C / T était par Cu21 et Ni21.
ANTIOXYDANTS
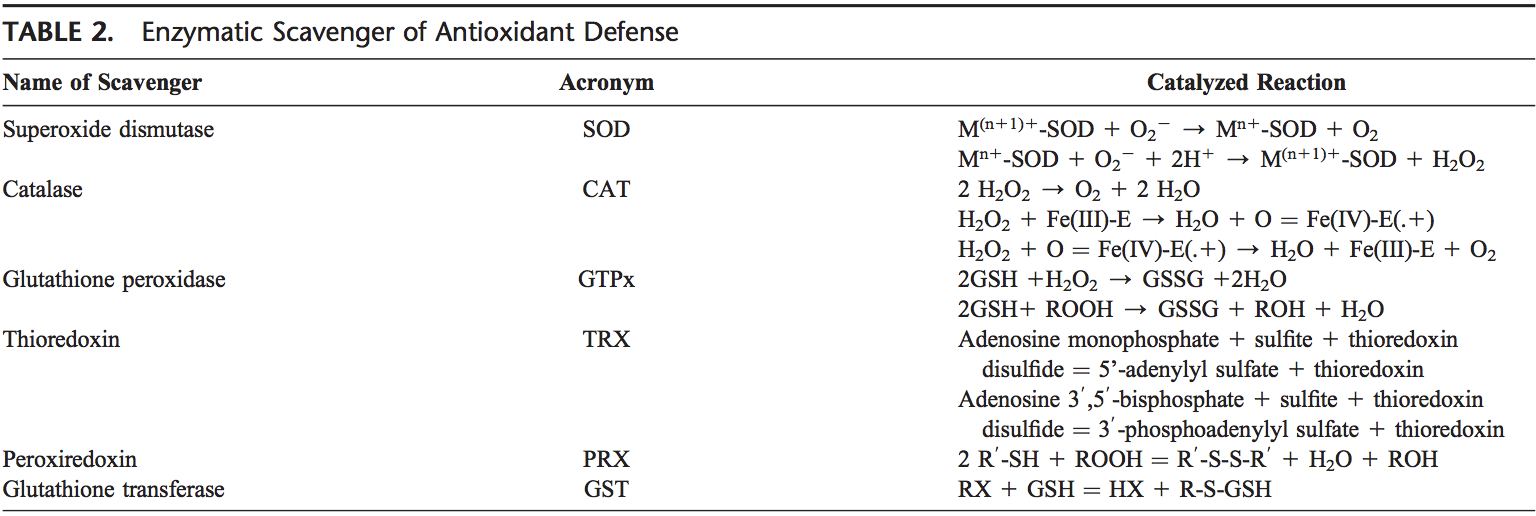
Le corps humain est équipé d'une variété d'antioxydants qui servent à contrebalancer l'effet des oxydants. À toutes fins pratiques, ils peuvent être divisés en catégories 2: enzymatique (tableau 2) et non enzymatique (tableau 3).
Antioxydants enzymatiques
Les principaux antioxydants enzymatiques des poumons sont les SOD (EC 1.15.1.11), la catalase (EC 1.11.1.6) et le GSH-Px (EC 1.11.1.9). En plus de ces enzymes principales, d'autres antioxydants, y compris l'hème oxygénase 1 (EC 1.14.99.3), et les protéines redox, comme les thiorédoxines (TRXs, EC 1.8.4.10), les peroxiredoxines (PRX, EC 1.11.1.15), et les glutarédoxines, ont également été trouvés jouer des rôles cruciaux dans les défenses antioxydantes pulmonaires.
Puisque le superoxyde est le ROS primaire produit à partir d'une variété de sources, sa dismutation par SOD est d'une importance primordiale pour chaque cellule. Toutes les formes 3 de SOD, c'est-à-dire CuZn-SOD, Mn-SOD et EC-SOD, sont largement exprimées dans le poumon humain. Mn-SOD est localisé dans la matrice des mitochondries. La EC-SOD est principalement localisée dans la matrice extracellulaire, en particulier dans les zones contenant de grandes quantités de fibres de collagène de type I et autour des vaisseaux pulmonaires et systémiques. Il a également été détecté dans l'épithélium bronchique, l'épithélium alvéolaire et les macrophages alvéolaires.66,67 Dans l'ensemble, CuZn-SOD et Mn-SOD sont généralement considérés comme des capteurs de masse de radicaux superoxydes. Le niveau relativement élevé de EC-SOD dans le poumon avec sa liaison spécifique aux composants de la matrice extracellulaire peut représenter une composante fondamentale de la protection de la matrice pulmonaire.68
H2O2 qui est produite par l'action des SOD ou l'action des oxydases, telles que la xanthine oxydase, est réduite en eau par la catalase et le GSH-Px. La catalase existe sous la forme d'un tétramère composé de monomères identiques 4, chacun contenant un groupe hème sur le site actif. La dégradation de H2O2 est réalisée via la conversion entre les conformations 2 de la catalase-ferricatalase (fer coordiné en eau) et le composé I (fer complexé avec un atome d'oxygène). La catalase se lie également au NADPH en tant qu'équivalent réducteur pour empêcher l'inactivation oxydative de l'enzyme (formation du composé II) par H2O2 lorsqu'il est réduit en eau.69
Les enzymes du cycle redox responsables de la réduction de H2O2 et des hydroperoxydes lipidiques (produits à la suite de la peroxydation des lipides membranaires) comprennent le GSH-Pxs.70 Les GSH-Px sont une famille d'enzymes tétramériques qui contiennent la sélénocystéine, un acide aminé unique. sites actifs et utiliser des thiols de bas poids moléculaire, tels que le GSH, pour réduire H2O2 et les peroxydes lipidiques à leurs alcools correspondants. Quatre GSH-Px ont été décrits, codés par différents gènes: GSH-Px-1 (GSH-Px cellulaire) est omniprésent et réduit H2O2 et les peroxydes d'acides gras, mais pas les lipides peroxylés estérifiés.71 Les lipides estérifiés sont réduits par le GSH lié à la membrane -Px-4 (hydroperoxyde de phospholipide GSH-Px), qui peut utiliser plusieurs thiols de bas poids moléculaire différents comme équivalents réducteurs. GSH-Px-2 (GSH-Px gastro-intestinal) est localisé dans les cellules épithéliales gastro-intestinales où il sert à réduire les peroxydes alimentaires.72 GSH-Px-3 (GSH-Px extracellulaire) est le seul membre de la famille GSH-Px qui réside dans le compartiment extracellulaire et est considéré comme l'une des plus importantes enzymes antioxydantes extracellulaires chez les mammifères. Parmi ceux-ci, le GSH-Px extracellulaire est le plus largement étudié dans le poumon humain.73
En outre, l'élimination de H2O2 est étroitement associée à plusieurs enzymes contenant des thiols, à savoir les TRX (TRX1 et TRX2), les thiorédoxine réductases (EC 1.8.1.9) (TRR), les PRX (qui sont des thiorédoxine peroxydases) et les glutarédoxines.74
Deux TRX et TRR ont été caractérisés dans les cellules humaines, existant à la fois dans le cytosol et les mitochondries. Dans les poumons, TRX et TRR sont exprimés dans l'épithélium bronchique et alvéolaire et dans les macrophages. Six PRX différents ont été trouvés dans des cellules humaines, différant par leur compartimentation ultrastructurale. Des études expérimentales ont révélé l'importance de PRX VI dans la protection de l'épithélium alvéolaire. Le poumon humain exprime toutes les PRX dans l'épithélium bronchique, l'épithélium alvéolaire et les macrophages.75 PRX V a récemment été trouvé comme une peroxynitrite réductase, 76, ce qui signifie qu'il peut fonctionner comme un composé protecteur potentiel dans le développement de lésions pulmonaires médiées par ROS .77
Commun à ces antioxydants est l'exigence de NADPH comme équivalent réducteur. NADPH maintient catalase dans la forme active et est utilisé comme un cofacteur par TRX et GSH réductase (EC 1.6.4.2), qui convertit GSSG en GSH, un co-substrat pour le GSH-Pxs. Le NADPH intracellulaire, à son tour, est généré par la réduction de NADP1 par la glucose-6-phosphate déshydrogénase, la première enzyme limitant la vitesse de la voie phosphatase, lors de la conversion du glucose-6-phosphate en 6-phosphogluconolactone. En produisant du NADPH, la glucose-6-phosphate déshydrogénase est un déterminant essentiel de la capacité de tampon GSH cytosolique (GSH / GSSG) et, par conséquent, peut être considérée comme une enzyme antioxydante régulatrice essentielle.78,79
Les GST (EC 2.5.1.18), une autre famille d'enzymes antioxydantes, inactivent les métabolites secondaires, tels que les aldéhydes, les époxydes et les hydroperoxydes insaturés. Trois grandes familles de GST ont été décrites: GST cytosolique, GST mitochondriale, 80,81 et GST microsomale associée à la membrane qui joue un rôle dans le métabolisme de l'eicosanoïde et du GSH.82 Sept classes de GST cytosolique sont identifiées chez les mammifères, désignées Alpha, Mu, Pi, Sigma, Theta, Omega et Zeta.83-86 En conditions non stressées, les GST de classe Mu et Pi interagissent respectivement avec les kinases Ask1 et JNK et inhibent ces kinases.87-89 Il a été démontré que GSTP1 se dissocie de JNK dans réponse au stress oxydatif.89 GSTP1 interagit également physiquement avec PRX VI et conduit à la récupération de l'activité de l'enzyme PRX via la glutathionylation de la protéine oxydée.90
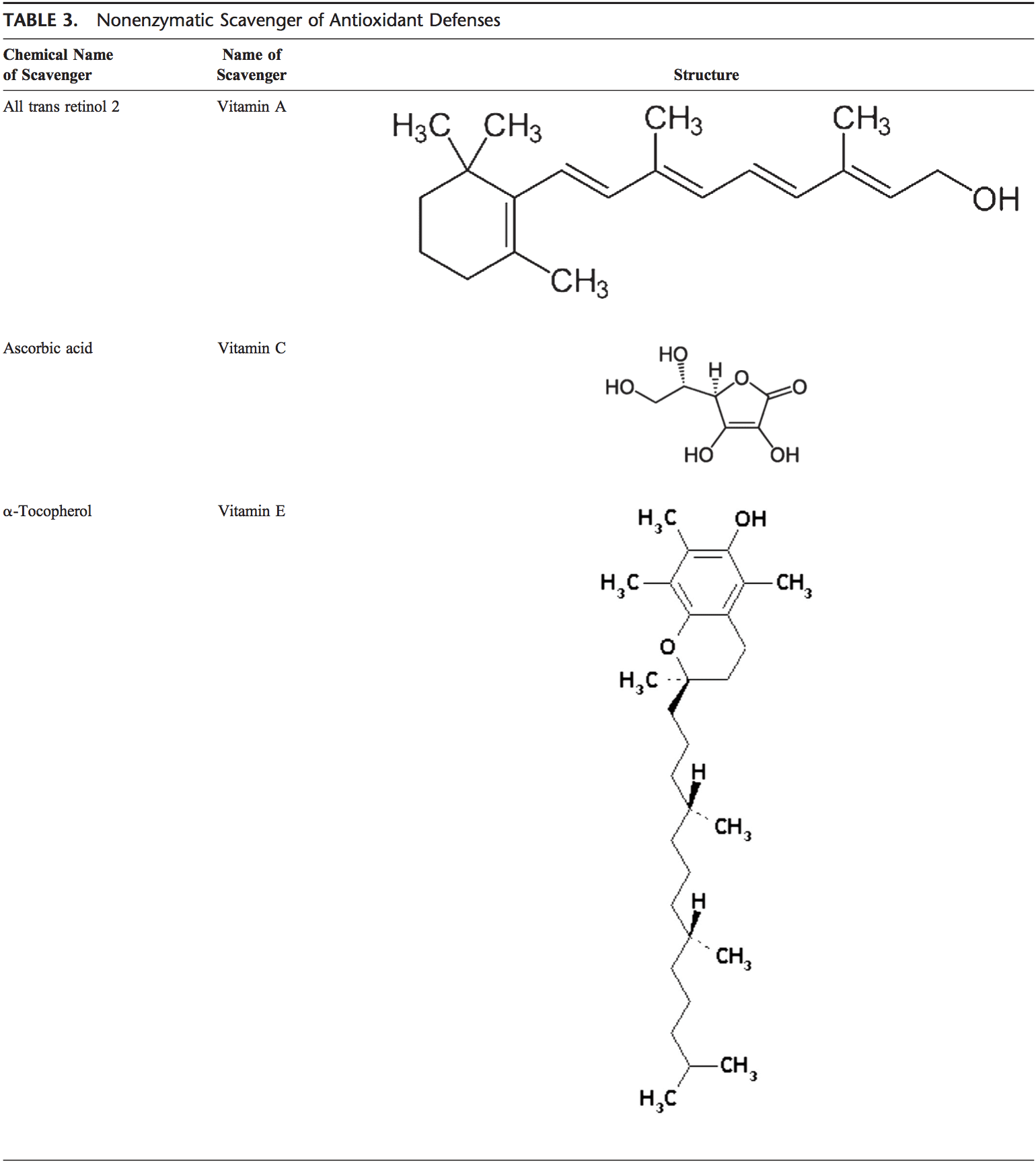
Antioxydants non-enzymatiques
Les antioxydants non-enzymatiques comprennent des composés de bas poids moléculaire, tels que les vitamines (vitamines C et E), le b-carotène, l'acide urique et le GSH, un tripeptide (Lg-glutamyl-L-cystéinyl-L-glycine) comprenant un thiol ( groupe sulfhydryle).
La vitamine C (acide ascorbique)
La vitamine C hydrosoluble (acide ascorbique) fournit une capacité antioxydante intracellulaire et extracellulaire en phase aqueuse, principalement en piégeant les radicaux libres d'oxygène. Il convertit les radicaux libres de la vitamine E en vitamine E. Il a été démontré que ses taux plasmatiques diminuent avec l'âge.91,92
Vitamine E (a-tocophérol)
La vitamine E liposoluble est concentrée dans le site interne hydrophobe de la membrane cellulaire et constitue la principale défense contre les lésions membranaires induites par l'oxydant. La vitamine E donne un électron au radical peroxyle, qui est produit au cours de la peroxydation lipidique. L'a-tocophérol est la forme la plus active de vitamine E et le principal antioxydant lié à la membrane cellulaire. La vitamine E déclenche l'apoptose des cellules cancéreuses et inhibe les formations radicalaires.93
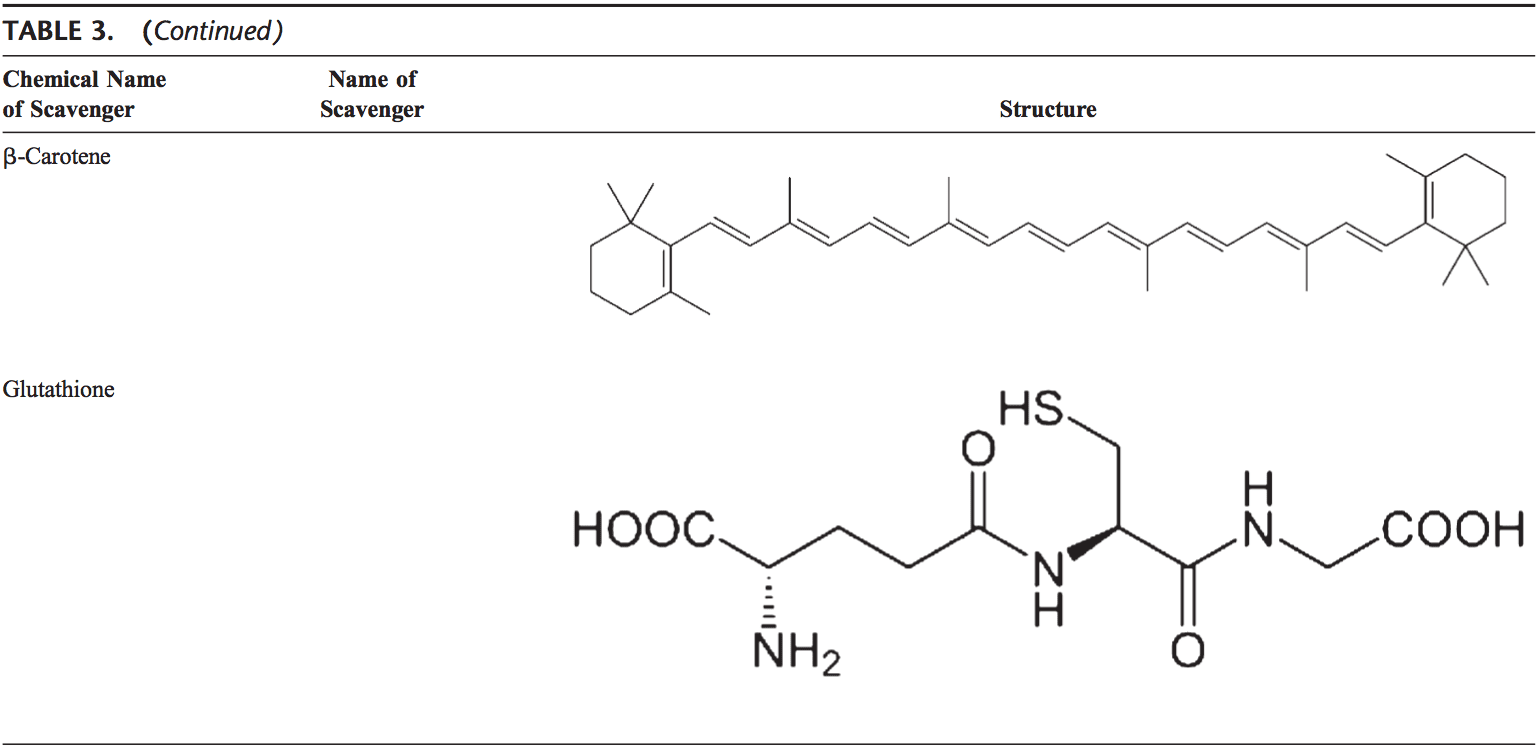
Le glutathion
Le GSH est très abondant dans tous les compartiments cellulaires et est le principal antioxydant soluble. Le rapport GSH / GSSG est un déterminant majeur du stress oxydatif. GSH montre ses effets antioxydants de plusieurs façons. 94 Il détoxifie le peroxyde d'hydrogène et les peroxydes lipidiques via l'action de GSH-Px. GSH fait don de son électron à H2O2 pour le réduire en H2O et O2. Le GSSG est de nouveau réduit en GSH par la GSH réductase qui utilise le NAD (P) H comme donneur d'électrons. Les GSH-Px sont également importants pour la protection de la membrane cellulaire contre la peroxydation des lipides. Le glutathion réduit donne des protons aux lipides membranaires et les protège des attaques oxydantes.95
Le GSH est un cofacteur de plusieurs enzymes détoxifiantes, comme le GSH-Px et la transferase. Il a un rôle dans la conversion de la vitamine C et E à leurs formes actives. Le GSH protège les cellules contre l'apoptose en interagissant avec les voies de signalisation pro-apoptotiques et anti-apoptotiques.94 Il régule et active également plusieurs facteurs de transcription, tels que AP-1, NF-kB et Sp-1.
Caroténoïdes (b-carotène)
Les caroténoïdes sont des pigments trouvés dans les plantes. Principalement, le b-carotène réagit avec les radicaux peroxyle (ROO), hydroxyle (OH) et superoxyde (O22.). Les caroténoïdes 96 montrent leurs effets antioxydants dans une faible pression partielle d'oxygène, mais peuvent avoir des effets pro-oxydants à plus forte teneur en oxygène. concentrations.97 Les deux caroténoïdes et les acides rétinoïques (RA) sont capables de réguler les facteurs de transcription.98 b-carotène inhibe l'activation NF-kB induite par oxydant et l'interleukine (IL) -6 et la production de facteur de nécrose tumorale-a. Les caroténoïdes affectent également l'apoptose des cellules. Les effets antiprolifératifs de la PR ont été démontrés dans plusieurs études. Cet effet de la PR dépend principalement des récepteurs de l'acide rétinoïque et varie selon les types de cellules. Dans les cellules du carcinome mammaire, le récepteur de l'acide rétinoïque a été montré pour déclencher l'inhibition de la croissance en induisant l'arrêt du cycle cellulaire, l'apoptose, ou les deux.99,100
L'EFFET DU STRESS OXYDATIF: MÉCANISMES GÉNÉTIQUES, PHYSIOLOGIQUES ET BIOCHIMIQUES
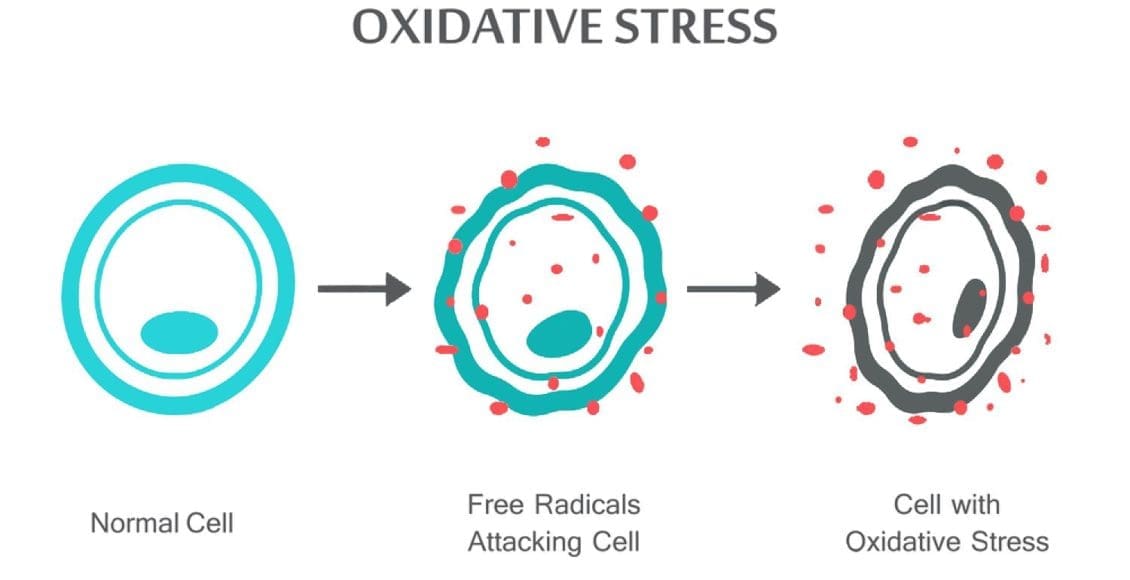
Le stress oxydatif se produit lorsque l'équilibre entre les antioxydants et les ROS est perturbé en raison de l'épuisement des antioxydants ou de l'accumulation de ROS. Lorsque le stress oxydatif se produit, les cellules tentent de neutraliser les effets oxydants et de rétablir l'équilibre redox par l'activation ou la désactivation des gènes codant pour les enzymes défensives, les facteurs de transcription et les protéines structurales.101,102 Ratio entre le glutathion oxydé et réduit (2GSH / GSSG) des déterminants importants du stress oxydatif dans le corps. Une production plus élevée de ROS dans le corps peut modifier la structure de l'ADN, entraîner une modification des protéines et des lipides, l'activation de plusieurs facteurs de transcription induits par le stress et la production de cytokines pro-inflammatoires et anti-inflammatoires.
Effets du stress oxydatif sur l'ADN
Les ROS peuvent conduire à des modifications de l'ADN de plusieurs manières, impliquant la dégradation de bases, des cassures d'ADN simple ou double brin, des modifications de la purine, de la pyrimidine ou du sucre, des mutations, des délétions ou des translocations. La plupart de ces modifications de l'ADN (figure 1) sont très pertinentes pour la carcinogenèse, le vieillissement et les maladies neurodégénératives, cardiovasculaires et auto-immunes. La fumée du tabac, les métaux redox et les métaux non redox, tels que le fer, le cadmium, le chrome et l'arsenic, sont également impliqués dans la carcinogenèse et le vieillissement en générant des radicaux libres ou en se liant à des groupes thiol. La formation de 8-OH-G est la lésion de l'ADN la plus connue se produisant par l'intermédiaire du stress oxydatif et est un biomarqueur potentiel de la cancérogenèse.
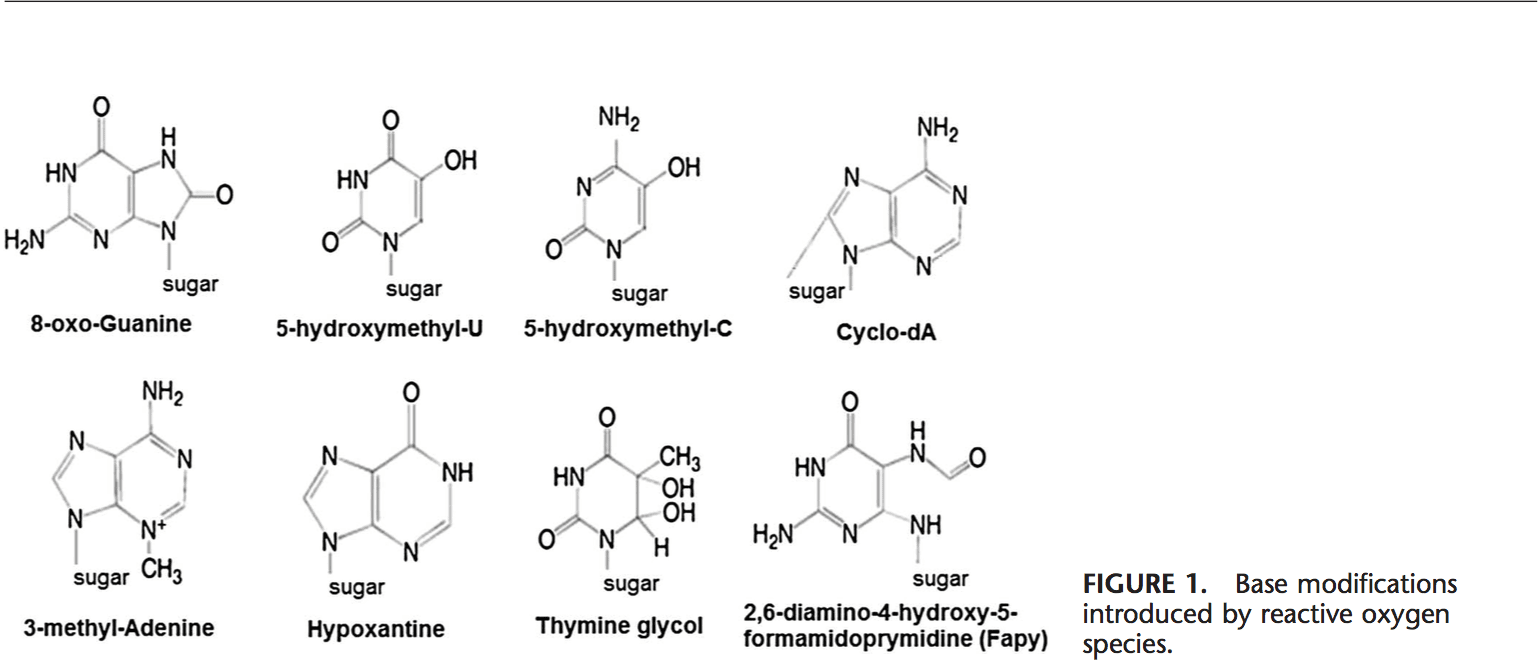
Les régions promotrices des gènes contiennent des séquences consensus pour les facteurs de transcription. Ces sites de liaison aux facteurs de transcription contiennent des séquences riches en GC qui sont sensibles aux attaques oxydantes. La formation de l'ADN 8-OH-G dans les sites de liaison du facteur de transcription peut modifier la liaison des facteurs de transcription et ainsi modifier l'expression des gènes apparentés, comme cela a été montré pour les séquences cibles AP-1 et Sp-1.103 Outre 8-OH-G, 8,59 -cyclo-29-désoxyadénosine (cyclo-dA) a également été montré pour inhiber la transcription d'un gène rapporteur dans un système cellulaire s'il est situé dans une boîte TATA.104 La protéine de liaison TATA initie la transcription en changeant la flexion de l'ADN. La liaison de la protéine se liant à TATA peut être altérée par la présence de cyclo-dA.
Le stress oxydatif provoque l'instabilité des régions microsatellites (courtes répétitions en tandem). Les ruptures d'ADN monocaténaires causées par une lésion oxydante peuvent facilement être tolérées par les cellules, les ruptures d'ADN double brin induites par les rayonnements ionisants peuvent constituer une menace importante pour la survie des cellules.105
La méthylation des îlots CpG dans l'ADN est un mécanisme épigénétique important qui peut entraîner l'inactivation des gènes. L'oxydation de 5-MeCyt en 5-hydroxyméthyluracile (5-OHMeUra) peut se produire par des réactions de désamination / oxydation de la thymine ou des intermédiaires 5-hydroxyméthyl cytosine.107 En plus de l'expression génique modulante, la méthylation de l'ADN semble également affecter l'organisation de la chromatine.108 Des profils de méthylation aberrants de l'ADN induits par des attaques oxydatives affectent également l'activité de réparation de l'ADN.
Effets du stress oxydatif sur les lipides
Les produits ROS peuvent induire une peroxydation lipidique et perturber l'arrangement bicouche lipidique membranaire qui peut inactiver les récepteurs membranaires et les enzymes et augmenter la perméabilité tissulaire.109 Les produits de la peroxydation lipidique, tels que le MDA et les aldéhydes insaturés, sont capables d'inactiver de nombreuses protéines cellulaires. 110 112 4-Hydroxy 2 nonenal provoque une déplétion du GSH intracellulaire et induit la production de peroxyde, 113,114 active le récepteur du facteur de croissance épidermique, 115 et induit la production de fibronectine.116 Produits de peroxydation lipidique, tels que les isoprostanes et les substances réactives à l'acide thiobarbiturique , ont été utilisés comme biomarqueurs indirects du stress oxydatif, et des niveaux accrus ont été montrés dans le condensat de souffle exhalé ou le liquide de lavage broncho-alvéolaire ou le poumon des patients atteints de maladies pulmonaires obstructives chroniques ou des fumeurs.117-119
Effets du stress oxydatif sur les protéines
Les ROS peuvent causer la fragmentation de la chaîne peptidique, l'altération de la charge électrique des protéines, la réticulation des protéines et l'oxydation des acides aminés spécifiques, entraînant ainsi une augmentation de la sensibilité à la protéolyse par dégradation par des protéases spécifiques.120 Cystéine et méthionine 121 L'oxydation des groupes sulfhydryle ou des résidus méthionine des protéines provoque des changements conformationnels, le dépliement des protéines et la dégradation.8,121-123 Les enzymes qui ont des métaux sur ou près de leurs sites actifs sont particulièrement sensibles à l'oxydation catalysée par les métaux. Il a été démontré que la modification oxydative des enzymes inhibe leurs activités.124,125
Dans certains cas, une oxydation spécifique des protéines peut avoir lieu. Par exemple, la méthionine peut être oxydée en méthionine sulfoxyde126 et en phénylalanine en o-tyrosine127; les groupes sulfhydryle peuvent être oxydés pour former des liaisons disulfure, 128 et les groupes carbonyle peuvent être introduits dans les chaînes latérales des protéines. Les rayons gamma, l'oxydation catalysée par des métaux, HOCl et l'ozone peuvent entraîner la formation de groupes carbonyles.129
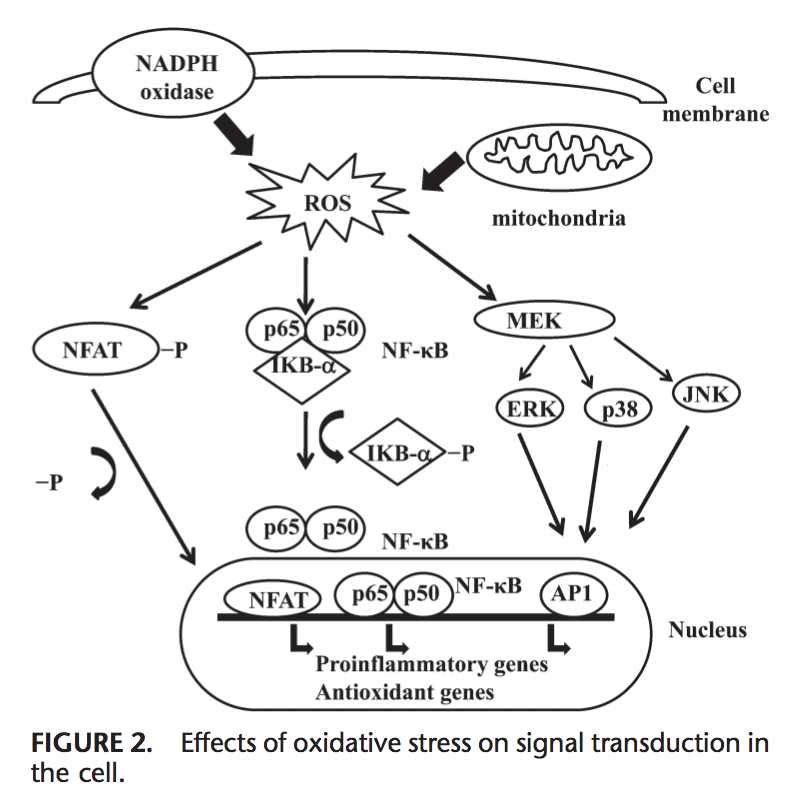
Effets du stress oxydatif sur la transduction du signal
Les ROS peuvent induire l'expression de plusieurs gènes impliqués dans la transduction du signal.1,130 Un rapport élevé pour le GSH / GSSG est important pour la protection de la cellule contre les dommages oxydatifs. La perturbation de ce rapport provoque l'activation de facteurs de transcription sensibles au redox, tels que NF-kB, AP-1, facteur nucléaire des cellules T activées et facteur inductible par l'hypoxie 1, qui sont impliqués dans la réponse inflammatoire. L'activation des facteurs de transcription via ROS est réalisée par des cascades de transduction du signal qui transmettent l'information de l'extérieur à l'intérieur de la cellule. Les récepteurs de la tyrosine kinase, la plupart des récepteurs du facteur de croissance, tels que le récepteur du facteur de croissance épidermique, le récepteur du facteur de croissance endothélial vasculaire et le récepteur du facteur de croissance dérivé des plaquettes, les protéines tyrosine phosphatases et les sérine / thréonine kinases sont des cibles de ROS.131-133. Les kinases régulées par le signal extracellulaire, JNK, et p38, qui sont des membres de la famille des protéines kinases activées par les mitogènes et impliquées dans plusieurs processus cellulaires, notamment la prolifération, la différenciation et l'apoptose, peuvent également être régulées par les oxydants.
Dans des conditions de stress oxydatif, les résidus de cystéine dans le site de liaison à l'ADN de c-Jun, certaines sous-unités AP-1 et la kB kinase inhibitrice subissent une S-glutathiolation réversible. Il a été rapporté que la glutarédoxine et le TRX jouent un rôle important dans la régulation des voies de signalisation sensibles au redox, telles que NF-kB et AP-1, la protéine kinase p38 activée par un mitogène et JNK.134-137.
NF-kB peut être activé en réponse à l'oxydation conditions de stressLa phosphorylation de IkB libère NF-kB et lui permet d'entrer dans le noyau pour activer la transcription du gène.138 Un certain nombre de kinases ont été rapportées pour phosphoryler les IkB au niveau des résidus sérine. Ces kinases sont les cibles de signaux oxydants pour l'activation des agents réducteurs de NF-kB.139, qui améliorent la liaison de l'ADN de NF-kB, alors que les agents oxydants inhibent la liaison de l'ADN de NF-kB. TRX peut exercer des actions opposées 140 dans la régulation de NF-kB: dans le cytoplasme, il bloque la dégradation de IkB et inhibe l'activation de NF-kB mais renforce la liaison de l'ADN NF-kB dans le noyau.2 Activation de NF-kB par dégradation liée à l'oxydation de IkB entraîne l'activation de plusieurs gènes liés à la défense antioxydante. NF-kB régule l'expression de plusieurs gènes qui participent à la réponse immunitaire, tels que IL-141b, IL-1, facteur de nécrose tumorale-a, IL-6 et plusieurs molécules d'adhésion.8 NF-kB régule également l'angiogenèse et la prolifération et différenciation des cellules.
AP-1 est également régulé par l'état redox. En présence de H2O2, certains ions métalliques peuvent induire l'activation de AP-1. L'augmentation du rapport GSH / GSSG augmente la liaison AP-1 tandis que GSSG inhibe la liaison à l'ADN de l'AP-1.144 La liaison de l'hétérodimère Fos / Jun à l'ADN est augmentée par la réduction d'une seule cystéine conservée dans le domaine de liaison à l'ADN de chacun. Les protéines 145 peuvent être inhibées par GSSG dans de nombreux types de cellules, suggérant que la formation de liaisons disulfure par les résidus de cystéine inhibe la liaison de l'ADN AP-1. La transduction du signal par le stress oxydatif est résumée sur la figure 1.
CONCLUSIONS
Le stress oxydatif peut résulter de la surproduction de ROS par des réactions métaboliques qui utilisent l'oxygène et modifient l'équilibre entre oxydant /des propriétés antioxydantes statuts en faveur des oxydants. Les ROS sont produits par des activités métaboliques cellulaires et des facteurs environnementaux, tels que les polluants atmosphériques ou la fumée de cigarette. Les ROS sont des molécules hautement réactives à cause des électrons non appariés dans leur structure et réagissent avec plusieurs macromolécules biologiques dans les cellules, telles que les hydrates de carbone, les acides nucléiques, les lipides et les protéines, et modifient leurs fonctions. ROS affecte également l'expression de plusieurs gènes par la régulation à la hausse des facteurs de transcription redox-sensibles et le remodelage de la chromatine par l'altération de l'acétylation / désacétylation des histones. La régulation de l'état redox est critique pour la viabilité cellulaire, l'activation, la prolifération et la fonction des organes.
Références:
Références
1. Valko M, CJ Rhodes, Moncol J, M Izakovic, Mazur M. Radicaux libres, des métaux et des antioxydants dans le cancer induit par le stress oxydatif. Chem Biol Interact. 2006; 160: 1-40.
2. Halliwell B, Gutteridge JMC. Les radicaux libres en biologie et en médecine. 3rd ed. New York: Oxford University Press, 1999.
3. Marnett LJ. Dégradation des lipides par l'ADD par le malondialdéhyde. Mutat Res. 1999; 424: 83-95.
4. Siems WG, Grune T, Esterbauer H. Formation de 4-Hydroxynonenal pendant l'ischémie et la reperfusion de l'intestin grêle de rat. Life Sci. 1995; 57: 785–789.
5. Stadtman ER. Rôle des espèces oxydantes dans le vieillissement. Curr Med Chem. 2004; 11: 1105-1112.
6. Wang MY, Dhingra K, Hittelman WN, Liehr JG, deAndrade M, Li DH. Additifs putatifs de malondialdéhyde-ADN induits par la peroxydation lipidique dans les tissus mammaires humains. Cancer Biomarqueurs Epidemiol Prev. 1996; 5: 705-710.
7. Jenner P. Stress oxydatif dans la maladie de Parkinson. Ann Neurol. 2003; 53: S26-S36.
8. Lyras L, NJ Cairns, Jenner A, P Jenner, Halliwell B. Une évaluation des dommages oxydatifs aux protéines, aux lipides et à l'ADN dans le cerveau des patients atteints de la maladie d'Alzheimer. J Neurochem. 1997; 68: 2061-2069.
9. Sayre LM, Smith MA, Perry G. Chimie et biochimie du stress oxydatif dans les maladies neurodégénératives. Curr Med Chem. 2001; 8: 721-738.
10. Toshniwal PK, Zarling EJ. Preuve d'augmentation de la peroxydation lipidique dans la sclérose en plaques. Neurochem Res. 1992; 17: 205-207.
11. Dhalla NS, Temsah RM, Netticadan T. Rôle du stress oxydatif dans les maladies cardiovasculaires. J Hypertens. 2000; 18: 655-673.
12. Kasparova S, Brezova V, M Valko, J Horecky, Mlynarik V, et al. Étude du stress oxydatif dans un modèle d'hypoperfusion cérébrale chronique chez le rat. Neurochem Int. 2005; 46: 601-611.
13. Kerr S, MJ Brosnan, McIntyre M, Reid JL, AF Dominiczak, Hamilton CA. La production d'anions superoxyde est augmentée dans un modèle d'hypertension génétique: rôle de l'endothélium. Hypertension. 1999; 33: 1353-1358.
14. Kukreja RC, Hess ML. Le système des radicaux libres de l'oxygène: des équations à travers les interactions membrane-protéine à la lésion et à la protection cardiovasculaire. Cardiovasc Res. 1992; 26: 641-655.
15. Asami S, H Manabe, Miyake J, Tsurudome Y, Hirano T, et al. Le tabagisme induit une augmentation des lésions oxydatives de l'ADN, 8-hydroxydeoxyguanosine, dans un site central du poumon humain. Carcinogenèse 1997; 18: 1763-1766.
16. Andreadis AA, Hazen SL, Comhair SA, Erzurum SC. Les événements oxydatifs et nitrosatifs dans l'asthme. Gratuit Radic Biol Med. 2003; 35: 213-225.
17. Comhair SA, Ricci KS, M Arroliga, Lara AR, Dweik RA, et al. Corrélation de la carence en superoxyde dismutase systémique à l'obstruction de l'air dans l'asthme. Am J Respir Crit Care Med. 2005; 172: 306-313.
18. Comhair SA, Xu W, Ghosh S, FB de Thunnissen, Almasan A, et al. Inactivation de la superoxyde dismutase en physiopathologie du remodelage et de la réactivité des voies aériennes asthmatiques. Am J Pathol. 2005; 166: 663-674.
19. Dut R, Dizdar EA, Birben E, Sackesen C, Soyer OU, Besler T, Kalayci O. Stress oxydatif et ses déterminants dans les voies respiratoires des enfants atteints d'asthme. Allergie. 2008; 63: 1605-1609.
20. Ercan H, Birben E, EA Dizdar, Keskin O, Karaaslan C, et al. Stress oxydatif et déterminants génétiques et épidémiologiques de la lésion oxydante dans l'asthme infantile. J Allergy Clin Immunol. 2006; 118: 1097-1104.
21. Fitzpatrick AM, Teague WG, F Holguin, Yeh M, Brown LA. Programme de recherche sur l'asthme grave. L'homéostasie du glutathion des voies respiratoires est modifiée chez les enfants atteints d'asthme sévère: preuve du stress oxydant. J Allergy Clin Immunol. 2009; 123: 146-152.
22. Miller DM, Buettner GR, Aust SD. Métaux de transition en tant que catalyseurs de réactions «d'autoxydation». Radic gratuit Biol Med. 1990; 8: 95 – 108.
23. Dupuy C, Virion A, R Ohayon, J Kaniewski, Dème D, Pommier J. Mécanisme de formation de peroxyde d'hydrogène catalysé par la NADPH oxydase dans la membrane plasmique thyroïdienne. J Biol Chem. 1991; 266: 3739-3743.
24. Granger DN. Rôle de la xanthine oxydase et des granulocytes dans les lésions d'ischémiesperfusion. Am J Physiol. 1988; 255: H1269-H1275.
25. Fenton HJH. Oxydation de l'acide tartrique en présence de fer. J Chem Soc. 1984; 65: 899-910.
26. Haber F, les juges Weiss La décomposition catalytique du peroxyde d'hydrogène par les sels de fer. Proc R Soc Lond S A. 1934; 147: 332-351.
27. Liochev SI, Fridovich I. Le Haber-Weiss cyclé 70 ans plus tard: une vue alternative. Redox Rep. 2002; 7: 55-57.
28. Klebanoff SJ. Myéloperoxydase: ami et ennemi. J Leukoc Biol. 2005; 77: 598-625.
29. Whiteman M, Jenner A, Halliwell B. Modifications de base induites par l'acide hypochloreux dans l'ADN du thymus de veau isolé. Chem Res Toxicol. 1997; 10: 1240-1246.
30. Kulcharyk PA, Heinecke JW. L'acide hypochloreux produit par le système myéloperoxydase des phagocytes humains induit des liaisons croisées covalentes entre l'ADN et la protéine. Biochimie. 2001; 40: 3648-3656.
31. Brennan ML, Wu W, Fu X, Shen Z, Song W, et al. Un récit de deux controverses: définir à la fois le rôle des peroxydases dans la formation de nitrotyrosine in vivo en utilisant la peroxydase d'éosinophiles et les souris myéloperoxiques déficientes, et la nature des espèces d'azote réactif générées par la peroxydase. J Biol Chem. 2002; 277: 17415-17427.
32. Denzler KL, Borchers MT, JR Crosby, Cieslewicz G, Hines EM, et al. La dégranulation extensive des éosinophiles et l'oxydation induite par la peroxydase des protéines des voies respiratoires ne se produisent pas dans un modèle d'infection pulmonaire à l'ovalbumine chez les souris. J Immunol. 2001; 167: 1672-1682.
33. Le juge en chef van Dalen, CC Winterbourn, Senthilmohan R, Kettle AJ. Le nitrite en tant que substrat et inhibiteur de la myéloperoxydase. Implications pour la nitration et la production d'acide hypochloreux sur les sites d'inflammation. J Biol Chem. 2000; 275: 11638-11644.
34. Wood LG, DA Fitzgerald, Gibson PG, Cooper DM, Garg ML. La peroxydation lipidique telle que déterminée par les isoprostanes plasmatiques est liée à la sévérité de la maladie dans l'asthme léger. Lipides. 2000; 35: 967-974.
35. Montuschi P, Corradi M, Ciabattoni G, Nightingale J, Kharitonov SA, Barnes PJ. Augmentation de 8-isoprostane, un marqueur du stress oxydatif, dans le condensat exhalé des patients asthmatiques. Am J Respir Crit Care Med. 1999; 160: 216-220.
36. Église DF, Pryor WA. La chimie radicalaire de la fumée de cigarette et ses implications toxicologiques. Environ Santé Perspective. 1985; 64: 111-126.
37. Hiltermann JT, TS Lapperre, van Bree L, Steerenberg PA, Brahim JJ, et al. Inflammation induite par l'ozone évaluée dans l'expectoration et le liquide de lavage bronchique des asthmatiques: un nouvel outil non invasif dans les études épidémiologiques sur la pollution de l'air et l'asthme. Gratuit Radic Biol Med. 1999; 27: 1448-1454.
38. Le juge Nightingale, Rogers DF, Barnes PJ. Effet de l'ozone inhalé sur l'oxyde nitrique exhalé, la fonction pulmonaire et les expectorations induites chez les sujets normaux et asthmatiques. Thorax. 1999; 54: 1061-1069.
39. Cho AK, C Sioutas, Miguel AH, Kumagai Y, Schmitz DA, et al. Activité redox des particules en suspension dans l'air à différents sites dans le bassin de Los Angeles. Environ Res. 2005; 99: 40-47.
40. Comhair SA, Thomassen MJ, Erzurum SC. Induction différentielle de la glutathion peroxydase extracellulaire et de l'oxyde nitrique synthase 2 dans les voies aériennes d'individus sains exposés à 100% O (2) ou à la fumée de cigarette. Am J Respir Cell Mol Biol. 2000; 23: 350-354.
41. Matthay MA, T Geiser, Matalon S, Ischiropoulos H. Lésion pulmonaire médiée par l'oxydant dans le syndrome de détresse respiratoire aiguë. Crit Care Med. 1999; 27: 2028-2030.
42. Biaglow JE, Mitchell JB, Held K. L'importance de peroxyde et de superoxyde dans la réponse aux rayons X. Int J Radiat Oncol Biol Phys. 1992; 22: 665-669.
43. Chiu SM, Xue LY, Friedman LR, Oleinick NL. Sensibilisation à médiation ionique par le cuivre des sites de fixation de la matrice nucléaire aux rayonnements ionisants. Biochimie. 1993; 32: 6214-6219.
44. PK Narayanan, Goodwin EH, Lehnert BE. Les particules alpha initient la production biologique d'anions superoxyde et de peroxyde d'hydrogène dans les cellules humaines. Cancer Res. 1997; 57: 3963-3971.
45. Tuttle SW, ME Varnes, Mitchell JB, Biaglow JE. Sensibilité aux oxydants chimiques et rayonnement dans les lignées cellulaires CHO déficientes dans l'activité du cycle oxydatif des pentoses. Int J Radiat Oncol Biol Phys. 1992; 22: 671-675.
46. Guo G, Yan-Sanders Y, Lyn-Cook BD, Wang T, Tamae D, et al. Manganèse
Expression génique médiée par la superoxyde dismutase
réponses adaptatives. Mol Cell Biol. 2003; 23: 2362-2378.
47. Azzam EI, de Toledo SM, Spitz DR, Little JB. Métabolisme oxydatif
module la transduction du signal et la formation du micronoyau dans le spectateur
cellules provenant de fibroblastes humains normaux irradiés par des particules. Cancer Res.
2002; 62: 5436-5442.
48. Leach JK, Van Tuyle G, Lin PS, Schmidt-Ullrich R, Mikkelsen RB.
Génération induite par les rayonnements ionisants, mitochondrie-dépendante
oxygène / azote. Cancer Res. 2001; 61: 3894-3901.
49. Dent P, Yacoub A, Fisher PB, MP Hagan, Grant S. MAPK voies dans
réponses de rayonnement. Oncogène. 2003; 22: 5885-5896.
50. Wei SJ, Botero A, Hirota K, Bradbury CM, Markovina S, et al. Thiorédoxine
La translocation nucléaire et l'interaction avec le facteur redox-1 activent le facteur de transcription AP-1 en réponse au rayonnement ionisant. Cancer Res. 2000; 60: 6688-6695.
51. Cadet J, Douki T, Gasparutto D, Ravanat JL. Dommages oxydatifs à l'ADN: formation, mesure et caractéristiques biochimiques. Mutat Res. 2003; 531: 5-23.
52. Yokoya A, Cunniffe SM, O'Neill P. Effet de l'hydratation sur l'induction des ruptures de brins et des lésions de base dans les films d'ADN plasmidique par gammaradiation. J Am Chem Soc. 2002; 124: 8859-8866.
53. Janssen YM, B Van Houten, PJ Borm, Mossman BT. Les réponses cellulaires et tissulaires aux dommages oxydatifs. Lab Invest. 1993; 69: 261-274.
54. Iwanaga M, Mori K, Iida T, Urata Y, Matsuo T, et al. Facteur nucléaire kappa B induction de la gamma glutamylcystéine synthétase par rayonnement ionisant dans des cellules de glioblastome humain T98G. Gratuit Radic Biol Med. 1998; 24: 1256-1268.
55. Stohs SJ, Bagchi D. Mécanismes oxydatifs dans la toxicité des ions métalliques. Gratuit Radic Biol Med. 1995; 18: 321-336.
56. Leonard SS, Harris GK, Shi X. Stress oxydatif induit par le métal et la transduction du signal. Gratuit Radic Biol Med. 2004; 37: 1921-1942.
57. Shi H, Shi X, Liu KJ. Mécanisme oxydatif de la toxicité de l'arsenic et de la cancérogenèse. Mol Cell Biochem. 2004; 255: 67-78.
58. Pi J, Horiguchi S, Sun Y, Nikaido M, Shimojo N, Hayashi T. Un mécanisme potentiel pour l'altération de la formation d'oxyde nitrique causée par une exposition orale prolongée à l'arséniate chez les lapins. Radic gratuit Biol Med.2003; 35: 102-113.
59. Rin K, Kawaguchi K, Yamanaka K, Tezuka M, Oku N, Okada S. Les ruptures d'ADN induites par l'acide diméthylarsinique, un métabolite de l'arsenic inorganique, sont fortement renforcées par les radicaux anion superoxyde. Biol Pharm Bull. 1995; 18: 45-58.
60. Waalkes MP, Liu J, Ward JM, Diwan LA. Mécanismes sous-jacents de la carcinogenèse de l'arsenic: hypersensibilité des souris exposées à l'arsenic inorganique pendant la gestation. Toxicologie. 2004; 198: 31-38.
61. Schiller CM, Fowler BA, Woods JS. Effets de l'arsenic sur l'activation de la pyruvate déshydrogénase. Environ Santé Perspective. 1977; 19: 205-207.
62. Monterio HP, Bechara EJH, Abdalla DSP. L'implication des radicaux libres dans les porphyries neurologiques et l'empoisonnement au plomb. Mol Cell Biochem. 1991; 103: 73-83.
63. Tripathi RM, Raghunath R, Mahapatra S. Le plomb sanguin et son effet sur les niveaux de Cd, Cu, Zn, Fe et l'hémoglobine des enfants. Sci Total Environ. 2001; 277: 161-168.
64. Nehru B, Dua R. L'effet du sélénium alimentaire sur la neurotoxicité du plomb. J Environ Pathol Toxicol Oncol. 1997; 16: 47-50.
65. Reid TM, Feig DI, Loeb LA. Mutagenèse par les radicaux oxygène induits par les métaux. Environ Santé Perspective. 1994; 102 (suppl 3): 57-61.
66. Kinnula VL, Crapo JD. Superoxyde dismutases dans les poumons et les maladies pulmonaires humaines. Am J Respir Crit Care Med. 2003; 167: 1600-1619.
67. Kinnula VL. Production et dégradation des métabolites de l'oxygène au cours des états inflammatoires dans le poumon humain. Drug Currics cible l'allergie inflammatoire. 2005; 4: 465-470.
68. Zelko IN, Mariani TJ, Folz RJ. Famille de la superoxyde dismutase multigène: comparaison des structures, de l'évolution et de l'expression des gènes CuZn-SOD (SOD1), Mn-SOD (SOD2) et EC-SOD (SOD3). Gratuit Radic Biol Med. 2002; 33: 337-349.
69. Kirkman HN, Rolfo M, Ferraris AM, Gaetani GF. Mécanismes de protection de la catalase par le NADPH. Cinétique et stoechiométrie. J Biol Chem. 1999; 274: 13908-13914.
70. Flohé L. Glutathion peroxydase. Basic Life Sci. 1988; 49: 663-668.
71. Arthur JR. Les glutathion peroxydases. Cell Mol Life Sci. 2000; 57: 1825-1835.
72. Chu FF, Doroshow JH, Esworthy RS. Expression, caractérisation et distribution tissulaire d'une nouvelle glutathion peroxydase cellulaire dépendante du sélénium, GSHPx-GI. J Biol Chem. 1993; 268: 2571-2576.
73. Comhair SA, PR Bhathena, Farver C, FB Thunnissen, Erzurum SC. Induction de la glutathion peroxydase extracellulaire dans les poumons asthmatiques: preuve de la régulation redox de l'expression dans les cellules épithéliales des voies respiratoires humaines. FASEB J. 2001; 15: 70-78.
74. Gromer S, S Urig, Becker K. Le système thiorédoxine de la science à la clinique. Med Res Rév. 2004; 24: 40-89.
75. Kinnula VL, S Lehtonen, R Kaarteenaho-Wiik, E Lakari, Pääkkö P, et al. Expression cellulaire spécifique des peroxiredoxines dans le poumon humain et la sarcoïdose pulmonaire. Thorax. 2002; 57: 157-164.
76. Dubuisson M, Vander Stricht D, Clippe A, Etienne F, Nauser T, et al. La peroxiredoxine humaine 5 est une peroxynitrite réductase. FEBS Lett. 2004; 571: 161-165.
77. Holmgren A. Fonction antioxydante des systèmes de thiorédoxine et de glutarédoxine. Signal Redox antioxydant. 2000; 2: 811-820.
78. Dickinson DA, Forman HJ. Le glutathion dans la défense et la signalisation: les leçons d'un petit thiol. Ann NY Acad Sci. 2002; 973: 488-504.
79. Sies H. Glutathione et son rôle dans les fonctions cellulaires. Gratuit Radic Biol Med. 1999; 27: 916-921.
80. Ladner JE, Parsons JF, CL Rife, GL Gilliland, Armstrong RN. Voies évolutives parallèles pour les glutathion transférases: structure et mécanisme de l'enzyme kappa mitochondriale de classe rGSTK1-1. Biochimie. 2004; 43: 52-61.
81. Robinson A, Huttley GA, Booth HS, Conseil d'administration PG. Des études de modélisation et de bioinformatique de la glutathion transférase de classe kappa humaine prédisent une nouvelle troisième famille de transférases avec une homologie avec les 2-hydroxychromène-2-carboxylate isomérases procaryotes. Biochem J. 2004; 379: 541-552.
82. Jakobsson PJ, Morgenstern R, Mancini J, Ford-Hutchinson A, Persson B. Caractéristiques structurelles communes de MAPEGDA superfamille généralisée de protéines associées à la membrane avec des fonctions très divergentes dans le métabolisme de l'eicosanoïde et du glutathion. Protéine Sci. 1999; 8: 689-692.
83. Hayes JD, Pulford DJ. La famille des glutathion S-transférase supergène: régulation de la GST et de la contribution des isoenzymes à la chimioprotection du cancer et à la pharmacorésistance. Crit Rev Biochem Mol Biol. 1995; 30: 445-600.
84. Armstrong RN. Structure, mécanisme catalytique et évolution des glutathion transferases. Chem Res Toxicol. 1997; 10: 2-18.
85. Hayes JD, McLellan LI. Le glutathion et les enzymes dépendantes du glutathion représentent une défense régulée de manière coordonnée contre le stress oxydatif. Radic Res gratuit 1999; 31: 273-300.
86. Sheehan D, Meade G, Foley VM, CA Dowd. Structure, fonction et évolution des glutathion transferases: implications pour la classification des membres non mammaliens d'une ancienne superfamille des enzymes. Biochem J. 2001; 360: 1-16.
87. Cho SG, Lee YH, Parc HS, Ryoo K, Kang KW, et al. La glutathion S-transférase Mu module les signaux activés par le stress en supprimant la kinase régulatrice du signal de l'apoptose 1. J Biol Chem. 2001; 276: 12749-12755.
88. Dorion S, Lambert H, J. Landry L'activation de la voie de signalisation p38 par choc thermique implique la dissociation de la glutathion S-transférase Mu d'Ask1. J Biol Chem. 2002; 277: 30792-30797.
89. Adler V, Yin Z, SY Fuchs, Benezra M, Rosario L, et al. Régulation de la signalisation JNK par GSTp. EMBO J. 1999; 18: 1321-1334.
90. Manevich Y, Feinstein SI, Fisher AB. L'activation de l'enzyme antioxydante 1-CYS peroxiredoxin nécessite une glutathionylation à médiation par hétérodimérisation avec pGST. Proc Natl Acad Sei US A. 2004; 101: 3780-3785.
91. Bunker VW. Radicaux libres, antioxydants et vieillissement. Med Lab Sci. 1992; 49: 299-312.
92. Mezzetti A, Lapenna D, Romano F, F Costantini, Pierdomenico SD, et al. Le stress oxydatif systémique et sa relation avec l'âge et la maladie. J Am Geriatr Soc. 1996; 44: 823-827.
93. White E, Shannon JS, Patterson RE. Relation entre la vitamine et
l'utilisation de suppléments de calcium et le cancer du côlon. Cancer Biomarqueurs Epidemiol Prev. 1997; 6: 769-774.
94. Masella R, Di Benedetto R, R Vari, Files C, Giovannini C. nouveaux mécanismes de composés antioxydants naturels dans les systèmes biologiques: l'implication du glutathion et des enzymes liées au glutathion. J Nutr Biochem. 2005; 16: 577-586.
95. Curello S, Ceconi C, C Bigoli, Ferrari R, Albertini A, Guarnieri C. Changements dans le statut de glutathion cardiaque après ischémie et reperfusion. Experientia. 1985; 41: 42-43.
96. El-Agamey A, GM Lowe, DJ McGarvey, Mortensen A, Phillip DM, Truscott TG. Chimie radicalaire caroténoïde et propriétés antioxydantes / pro-oxydantes. Arch Biochem Biophys. 2004; 430: 37-48.
97. Rice-Evans CA, J Sampson, MP Bramley, Holloway DE. Pourquoi attendons-nous que les caroténoïdes soient des antioxydants in vivo? Radic Res gratuit 1997; 26: 381-398.
98. Niles RM. Voies de signalisation dans la chimioprévention des rétinoïdes et le traitement du cancer. Mutat Res. 2004; 555: 81-96.
99. Donato LJ, Noy N. Suppression de la croissance du carcinome mammaire par l'acide rétinoïque: les gènes pro-apoptotiques sont des cibles pour le récepteur de l'acide rétinoïque et la signalisation de la protéine liant l'acide rétinoïque cellulaire II. Cancer Res. 2005; 65: 8193-8199.
100. Niizuma H, Nakamura Y, T Ozaki, Nakanishi H, Ohira M, et al. Bcl-2 est un régulateur clé de la mort cellulaire apoptotique induite par l'acide rétinoïque dans le neuroblastome. Oncogène. 2006; 25: 5046-5055.
101. Dalton TP, Shertzer HG, Puga A. Régulation de l'expression des gènes par l'oxygène réactif. Ann Rev Pharmacol Toxicol. 1999; 39: 67-101.
102. Scandalios JG. Réponses génomiques au stress oxydatif. Dans: Meyers RA, éd. Encyclopédie de la biologie cellulaire moléculaire et de la médecine moléculaire. Vol 5. 2nd éd. Weinheim, Allemagne: Wiley-VCH; 2004: 489-512.
103. Ghosh R, Mitchell DL. Effet de l'endommagement de l'ADN oxydatif dans les éléments promoteurs sur la liaison du facteur de transcription. Acides nucléiques Res. 1999; 27: 3213-3218.
104. Marietta C, Gulam H, Brooks PJ. Une seule lésion 8, 50-cyclo-20-désoxyadénosine dans une boîte TATA empêche la liaison de la protéine de liaison TATA et réduit fortement la transcription in vivo. Réparation d'ADN (Amst). 2002; 1: 967-975.
105. Jackson AL, Chen R, Loeb LA. Induction de l'instabilité des microsatellites
par des dommages à l'ADN oxydatif. Proc Natl Acad Sei US A. 1998; 95: 12468-12473.
106. Caldecott KW. Interactions protéine-protéine au cours de la réparation d'une rupture simple brin d'ADN de mammifère. Biochem Soc Trans. 2003; 31: 247-251.
107. Cooke MS, MD Evans, M Dizdaroglu, J. Lunec dommages oxydatifs de l'ADN: les mécanismes, les mutations et les maladies. FASEB J. 2003; 17: 1195-1214.
108. Jones PL, Wolffe AP. Les relations entre l'organisation de la chromatine et la méthylation de l'ADN dans la détermination de l'expression des gènes. Semin Cancer Biol. 1999; 9: 339-347.
109. Girotti AW. Mécanismes de peroxydation lipidique. J Free Radic Biol Med. 1985; 1: 87-95.
110. GM Siu, Draper HH. Métabolisme du malonaldéhyde in vivo et in vitro. Lipides. 1982; 17: 349-355.
111. Esterbauer H, Koller E, Slee RG, Koster JF. Implication possible du produit de lipo-peroxydation 4-hydroxynonenal dans la formation de chromolipides fluorescents. Biochem J. 1986; 239: 405-409.
112. Hagihara M, Nishigaki I, Maseki M, Yagi K. Changements dépendant de l'âge des niveaux de peroxyde de lipides dans les fractions de lipoprotéines du sérum humain. J Gerontol. 1984; 39: 269-272.
113. Keller JN, Mark RJ, Bruce AJ, E Blanc, Rothstein JD, et al. 4-Hydroxynonenal, un produit aldéhydique de la peroxydation des lipides membranaires, altère le transport du glutamate et la fonction mitochondriale dans les synaptosomes. Neuroscience. 1997; 806: 85-96.
114. Uchida K, Shiraishi M, Naito Y, Torii Y, Y Nakamura, Osawa T. Activation des voies de signalisation du stress par le produit final de la peroxydation lipidique. 4-hydroxy-2-nonenal est un inducteur potentiel de la production de peroxyde intracellulaire. J Biol Chem. 1999; 274: 2234-2242.
115. Suc I, Meilhac O, Lajoie-Mazenc I, Vandaele J, Jurgens G, Salvayre R, Negre-Salvayre A. Activation du récepteur de l'EGF par les LDL oxydées. FASEB J. 1998; 12: 665-671.
116. Tsukagoshi H, Kawata T, Shimizu Y, Ishizuka T, Dobashi K, Mori M. 4-Hydroxy-2-nonenal améliore la production de fibronectine par les fibroblastes pulmonaires humains IMR-90 en partie via l'activation de la kinase extracellulaire régulée par le récepteur du facteur de croissance épidermique. voie p44 / 42. Toxicol Appl Pharmacol. 2002; 184: 127-135.
117. Montuschi P, JV Collins, Ciabattoni G, N Lazzeri, Corradi M, Kharitonov SA, Barnes PJ. 8-isoprostane exhalé en tant que biomarqueur in vivo du stress oxydatif pulmonaire chez les patients atteints de BPCO et les fumeurs en bonne santé. Am J Respir Crit Care Med. 2000; 162: 1175-1177.
118. Morrison D, Rahman I, Lannan S, MacNee W. perméabilité épithéliale, l'inflammation et le stress oxydant dans les espaces aériens des fumeurs. Am J Respir Crit Care Med. 1999; 159: 473-479.
119. Nowak D, Kasielski M, Antczak A, Pietras T, Bialasiewicz P. Augmentation du contenu de substances réactives à l'acide thiobarbiturique et de peroxyde d'hydrogène dans le condensat expiré de patients atteints de maladie pulmonaire obstructive chronique stable: pas d'effet significatif de la cigarette. Respir Med. 1999; 93: 389-396.
120. Kelly FJ, Mudway IS. Oxydation des protéines à l'interface air-poumon. Acides aminés. 2003; 25: 375-396.
121. Dean RT, Roberts CR, Jessup W. Fragmentation des polypeptides extracellulaires et intracellulaires par les radicaux libres. Prog Clin Biol Res. 1985; 180: 341-350.
122. Keck RG. Utilisation de l'hydroperoxyde de t-butyle comme sonde pour l'oxydation de la méthionine dans les protéines. Anal Biochem. 1996; 236: 56-62.
123. Davies KJ. Dommages aux protéines et dégradation par les radicaux oxygène. I. Aspects généraux J Biol Chem. 1987; 262: 9895-9901.
124. Stadtman ER. Oxydation des protéines catalysée par les ions métalliques: mécanisme biochimique et conséquences biologiques. Gratuit Radic Biol Med.
1990; 9: 315-325.
125. Fucci L, Oliver CN, MJ Coon, Stadtman ER. Inactivation d'enzymes métaboliques clés par des réactions d'oxydation à fonctions mixtes: implication possible dans le renouvellement des protéines et le vieillissement. Proc Natl Acad Sei US A. 1983; 80: 1521-1525.
126. Stadtman ER, Moskovitz J, Levine RL. Oxydation des résidus méthionine des protéines: conséquences biologiques. Signal Redox antioxydant. 2003; 5: 577-582.
127. Stadtman ER, Levine RL. Oxydation par les radicaux libres d'acides aminés libres et de résidus d'acides aminés dans les protéines. Acides aminés. 2003; 25: 207-218.
128. Stadtman ER. L'oxydation des protéines dans le vieillissement et les maladies liées à l'âge. Ann NY Acad Sci. 2001; 928: 22-38.
129. Shacter E. Quantification et signification de l'oxydation des protéines dans les échantillons biologiques. Drug Metab Rév. 2000; 32: 307-326.
130. Poli G, Leonarduzzi G, Biasi F, Chiarpotto E. Stress oxydatif et la signalisation cellulaire. Curr Med Chem. 2004; 11: 1163-1182.
131. Neufeld G, T Cohen, Gengrinovitch S, Poltorak Z. Facteur de croissance vasculaire endothéliale (VEGF) et ses récepteurs. FASEB J. 1999; 13: 9-22.
132. Sundaresan M, Yu ZX, VJ Ferrans, DJ Sulciner, Gutkind JS, et al. Régulation de la génération des espèces réactives de l'oxygène dans les fibroblastes par Rac1. Biochem J. 1996; 318: 379-382.
133. Sun T, Oberley LW. Régulation redox des activateurs transcriptionnels. Gratuit Radic Biol Med. 1996; 21: 335-348.
134. Klatt P, Molina EP, De Lacoba MG, Padilla CA, Martinez-Galesteo E, JJ Barcena, Lamas S. Redox régulation de la liaison de l'ADN c-Jun par S-glutathiolation réversible. FASEB J. 1999; 13: 1481-1490.
135. Reynaert NL, CKless K, Guala AS, Wouters EF, van der Vliet A, Janssen Heininger
YM. Détection in situ de protéines S-glutathionylées après la dérivation de la cystéine catalysée par la glutarédoxine-1. Biochim Biophys Acta. 2006; 1760: 380-387.
136. Reynaert NL, Wouters EF, Janssen-Heininger YM. Modulation de la glutarédoxine-1
expression dans un modèle murin de maladie allergique des voies respiratoires. Am J Respir Cell Mol Biol. 2007; 36: 147-151.
137. Filomeni G, Rotilio G, Ciriolo MR. La signalisation cellulaire et le système redox du glutathion. Biochem Pharmacol. 2002; 64: 1057-1064.
138. Pande V, Ramos MJ. Reconnaissance moléculaire de la 15-désoxydelta (12,14) prostaglandine J (2) par le facteur nucléaire kappa B et d'autres protéines cellulaires. Bioorg Med Chem Lett. 2005; 15: 4057-4063.
139. Perkins ND. Intégration de voies de signalisation cellulaire avec fonction NF-kappaB et IKK. Nat Rev Mol Cell Biol. 2007; 8: 49-62.
140. Gilmore TD. Introduction à NF-kappaB: acteurs, parcours, perspectives. Oncogène. 2006; 25: 6680-6684.
141. Hirota K, Murata M, Sachi Y, Nakamura H, Takeuchi J, Mori K, Yodoi J. Rôles distincts de la thiorédoxine dans le cytoplasme et dans le noyau. Un mécanisme en deux étapes de la régulation redox du facteur de transcription NF-kappaB. J Biol Chem. 1999; 274: 27891-27897.
142. Ward PA. Rôle du complément, des chimiokines et des cytokines régulatrices dans les lésions pulmonaires aiguës. Ann NY Acad Sci. 1996; 796: 104-112.
143. Akira S, Kishimoto A. NF-IL6 et NF-kB dans la régulation des gènes des cytokines. Adv Immunol. 1997; 65: 1-46.
144. Meyer M, Schreck R, PA Baeuerle. H2O2 et les antioxydants ont des effets opposés sur l'activation de NF-kappa B et AP-1 dans les cellules intactes: AP-1 comme facteur secondaire antioxydant-sensible. EMBO J. 1993; 12: 2005-2015.
145. Abate C, Patel L, Rausher FJ, régulation de Curran Redox de fos et jun activité de liaison de l'ADN in vitro. Science. 1990; 249: 1157-1161.
146. Galter D, Mihm S, Droge W. Les effets distincts du disulfure de glutathion sur les facteurs de transcription nucléaire kB et la protéine activatrice-1. Eur J Biochem. 1994; 221: 639-648.
147. Hirota K, Matsui M, Iwata S, Nishiyama A, Mori K, Yodoi J. Activité transcriptionnelle AP-1 est régulée par une association directe entre la thiorédoxine et Ref-1. Proc Natl Acad Sei US A. 1997; 94: 3633-3638.
Déni de responsabilité
Champ d'exercice professionnel *
Les informations présentes sur "El Paso, TX Stress oxydatif et défense antioxydante" n'est pas destiné à remplacer une relation individuelle avec un professionnel de la santé qualifié ou un médecin agréé et ne constitue pas un avis médical. Nous vous encourageons à prendre des décisions en matière de soins de santé en fonction de vos recherches et de votre partenariat avec un professionnel de la santé qualifié.
Informations sur le blog et discussions sur la portée
Notre périmètre d'information se limite à la chiropratique, à l'appareil locomoteur, acupuncture, médecines physiques, bien-être, contribution étiologique troubles viscérosomatiques dans les présentations cliniques, la dynamique clinique du réflexe somatoviscéral associé, les complexes de subluxation, les problèmes de santé sensibles et/ou les articles, sujets et discussions sur la médecine fonctionnelle.
Nous fournissons et présentons collaboration clinique avec des spécialistes de diverses disciplines. Chaque spécialiste est régi par son champ d'exercice professionnel et sa juridiction de délivrance de permis. Nous utilisons des protocoles de santé et de bien-être fonctionnels pour traiter et soutenir les soins des blessures ou des troubles du système musculo-squelettique.
Nos vidéos, messages, sujets, sujets et idées couvrent des questions cliniques, des problèmes et des sujets qui se rapportent à et soutiennent directement ou indirectement notre champ de pratique clinique.*
Notre bureau a raisonnablement tenté de fournir des citations à l’appui et a identifié les études de recherche pertinentes à l’appui de nos publications. Nous fournissons des copies des études de recherche à l'appui disponibles aux organismes de réglementation et au public sur demande.
Nous comprenons que nous couvrons les questions qui nécessitent une explication supplémentaire de la façon dont cela peut aider dans un plan de soins ou un protocole de traitement particulier ; Par conséquent, pour discuter plus en détail du sujet ci-dessus, n'hésitez pas à demander Dr Alex Jimenez, DC, ou contactez-nous au 915-850-0900.
Nous sommes là pour vous aider, vous et votre famille.
Bénédictions
Dr. Alex Jimenez DC MSACP, Infirmière*, CCST, IFMCP*, CIFM*, ATN*
Courriel: coach@elpasofonctionalmedicine.com
Licencié en tant que docteur en chiropratique (DC) en Texas & Nouveau Mexique*
Numéro de licence Texas DC TX5807, Numéro de licence DC du Nouveau-Mexique NM-DC2182
Licence d'infirmière autorisée (RN *) en Floride
Licence de Floride RN Licence # RN9617241 (Numéro de contrôle 3558029)
Statut compact : Licence multi-États: Autorisé à exercer en États 40*
Actuellement immatriculé : ICHS : MSN* FNP (Programme d'infirmières praticiennes familiales)
Dr Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Ma carte de visite numérique


 Encore une fois, nous vous souhaitons la bienvenue¸
Encore une fois, nous vous souhaitons la bienvenue¸
