Les corps cétoniques sont créés par le foie et utilisés comme source d'énergie lorsque le glucose n'est pas facilement disponible dans le corps humain. Les deux principaux corps cétoniques sont l'acétoacétate (AcAc) et le 3-béta-hydroxybutyrate (3HB), tandis que l'acétone est le troisième et le moins abondant, corps cétonique. Les cétones sont toujours présentes dans le sang et leurs niveaux augmentent pendant les exercices à jeun et prolongés. Cétogénèse est le processus biochimique par lequel les organismes produisent des corps cétoniques par la dégradation des acides gras et des acides aminés cétogènes.
Les corps cétoniques sont principalement générés dans le mitochondries des cellules du foie. La cétogenèse se produit lorsque la glycémie est faible, en particulier après que les autres réserves de glucides cellulaires, telles que le glycogène, ont été épuisées. Ce mécanisme peut également se produire lorsque les quantités d'insuline sont insuffisantes. La production de corps cétoniques est finalement initiée pour produire de l’énergie qui est stockée dans le corps humain sous forme d’acides gras. La cétogenèse se produit dans les mitochondries où elle est régulée indépendamment.
Table des matières
Abstract
Le métabolisme du corps cétonique est un noeud central de l'homéostasie physiologique. Dans cette revue, nous discutons de la façon dont les cétones jouent des rôles métaboliques de réglage précis qui optimisent la performance d'organes et d'organismes dans divers restes de nutriments et protègent de l'inflammation et des blessures dans de multiples systèmes d'organes. Considérées traditionnellement comme des substrats métaboliques enrôlés uniquement dans la restriction glucidique, des observations récentes soulignent l’importance des corps cétoniques en tant que médiateurs vitaux du métabolisme et de la signalisation lorsque les glucides sont abondants. Complétant un répertoire d'options thérapeutiques connues pour les maladies du système nerveux, des rôles potentiels des corps cétoniques dans le cancer ont été créés, de même que des rôles protecteurs intrigants dans le cœur et le foie, ouvrant des options thérapeutiques dans les maladies liées à l'obésité et les maladies cardiovasculaires. Des controverses sur le métabolisme et la signalisation des cétones sont discutées afin de réconcilier le dogme classique avec les observations contemporaines.
Introduction
Les corps cétoniques sont une source de carburant métabolique alternative vitale pour tous les domaines de la vie, eucarya, bactéries et archées (Aneja et al., 2002 ; Cahill GF Jr, 2006 ; Krishnakumar et al., 2008). Le métabolisme des corps cétoniques chez l'homme a été mis à profit pour alimenter le cerveau pendant les périodes épisodiques de privation de nutriments. Les corps cétoniques sont entrelacés avec des voies métaboliques cruciales pour les mammifères telles que la β-oxydation (FAO), le cycle de l'acide tricarboxylique (TCA), la gluconéogenèse, la lipogenèse de novo (DNL) et la biosynthèse des stérols. Chez les mammifères, les corps cétoniques sont produits principalement dans le foie à partir d'acétyl-CoA dérivé de la FAO, et ils sont transportés vers les tissus extrahépatiques pour l'oxydation terminale. Cette physiologie fournit un carburant alternatif qui est complété par des périodes de jeûne relativement brèves, ce qui augmente la disponibilité des acides gras et diminue la disponibilité des glucides (Cahill GF Jr, 2006 ; McGarry et Foster, 1980 ; Robinson et Williamson, 1980). L'oxydation des corps cétoniques devient un contributeur important au métabolisme énergétique global des mammifères dans les tissus extrahépatiques dans une myriade d'états physiologiques, notamment le jeûne, la famine, la période néonatale, le post-exercice, la grossesse et l'adhésion à des régimes pauvres en glucides. Les concentrations totales de corps cétoniques circulants chez l'homme adulte en bonne santé présentent normalement des oscillations circadiennes entre environ 100 et 250 µM, montent à ~ 1 mM après un exercice prolongé ou 24 h de jeûne, et peuvent s'accumuler jusqu'à 20 mM dans des états pathologiques comme l'acidocétose diabétique (Cahill GF Jr, 2006 ; Johnson et al., 1969b ; Koeslag et al., 1980 ; Robinson et Williamson, 1980 ; Wildenhoff et al., 1974). Le foie humain produit jusqu'à 300 g de corps cétoniques par jour (Balasse et Fery, 1989), qui contribuent entre 5 et 20 % de la dépense énergétique totale dans les états nourris, à jeun et affamés (Balasse et al., 1978 ; Cox et al., 2016).
Des études récentes mettent maintenant en évidence les rôles impératifs des corps cétoniques dans le métabolisme des cellules de mammifère, l'homéostasie et la signalisation dans une grande variété d'états physiologiques et pathologiques. En plus de servir de combustibles énergétiques pour les tissus extrahépatiques tels que le cerveau, le coeur ou les muscles squelettiques, les corps cétoniques jouent un rôle essentiel en tant que médiateurs de signalisation, moteurs de la modification protéique post-traductionnelle des protéines (PTM) et modulateurs de l'inflammation et du stress oxydatif. Dans cette revue, nous fournissons des vues classiques et modernes des rôles pléiotropes des corps cétoniques et de leur métabolisme.
Aperçu du métabolisme du corps cétonique
Le taux de cétogenèse hépatique est régi par une série orchestrée de transformations physiologiques et biochimiques de la graisse. Les principaux régulateurs comprennent la lipolyse des acides gras à partir des triacylglycérols, le transport vers et à travers la membrane plasmique hépatocytaire, le transport dans les mitochondries via la carnitine palmitoyltransférase 1 (CPT1), la spirale d'oxydation ß, l'activité du cycle TCA et les concentrations intermédiaires, le potentiel redox et les régulateurs hormonaux de ces processus, principalement le glucagon et l'insuline [examiné dans (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al., 1983; Kahn et al., 2005; McGarry et Foster , 1980; Williamson et al., 1969)]. La cétogenèse est classiquement considérée comme une voie de débordement, dans laquelle l'acétyl-CoA dérivé de la ß-oxydation dépasse l'activité de la citrate synthase et / ou la disponibilité de l'oxaloacétate pour la condensation pour former du citrate. Les intermédiaires à trois carbones présentent une activité anti-cétogène, probablement en raison de leur capacité à élargir le pool d'oxaloacétate pour la consommation d'acétyl-CoA, mais la concentration hépatique d'acétyl-CoA ne détermine pas à elle seule le taux cétogène (Foster, 1967; Rawat et Menahan, 1975; Williamson et al., 1969). La régulation de la cétogenèse par des événements hormonaux, transcriptionnels et post-traductionnels soutiennent ensemble l'idée que les mécanismes moléculaires qui affinent le taux cétogène restent incomplètement compris (voir Régulation de HMGCS2 et SCOT / OXCT1).
La cétogenèse se produit principalement dans la matrice mitochondriale hépatique à des taux proportionnels à l'oxydation totale des graisses. Après le transport des chaînes acyles à travers les membranes mitochondriales et la ß-oxydation, l'isoforme mitochondriale de la 3-hydroxyméthylglutaryl-CoA synthase (HMGCS2) catalyse le destin en provoquant la condensation de l'acétoacétyl-CoA (AcAc-CoA) et de l'acétyl-CoA pour générer HMG-CoA (Fig. 1A). HMG-CoA lyase (HMGCL) clive HMG-CoA pour libérer de l'acétyl-CoA et de l'acétoacétate (AcAc), et ce dernier est réduit en d -? - hydroxybutyrate (d-? OHB) par la d-? OHB déshydrogénase mitochondriale dépendant de la phosphatidylcholine ( BDH1) dans une réaction de quasi-équilibre couplée NAD + / NADH (Bock et Fleischer, 1975; LEHNINGER et al., 1960). La constante d'équilibre BDH1 favorise la production de d-? OHB, mais le rapport des corps cétoniques AcAc / d-? OHB est directement proportionnel au rapport mitochondrial NAD + / NADH, et donc l'activité de la BDH1 oxydoréductase module le potentiel redox mitochondrial (Krebs et al., 1969; Williamson et al., 1967). L'AcAc peut également se décarboxyler spontanément en acétone (Pedersen, 1929), source d'odeur sucrée chez les humains souffrant d'acidocétose (c'est-à-dire, corps cétoniques sériques totaux> ~ 7 mM; AcAc pKa 3.6,? OHB pKa 4.7). Les mécanismes par lesquels les corps cétoniques sont transportés à travers la membrane interne mitochondriale ne sont pas connus, mais AcAc / d-? OHB sont libérés des cellules via des transporteurs monocarboxylates (chez les mammifères, MCT 1 et 2, également connus sous le nom de transporteur de soluté membres de la famille 16A 1 et 7) et transporté dans la circulation vers les tissus extrahépatiques pour l'oxydation terminale (Cotter et al., 2011; Halestrap et Wilson, 2012; Halestrap, 2012; Hugo et al., 2012). Les concentrations de corps cétoniques circulants sont plus élevées que celles des tissus extrahépatiques (Harrison et Long, 1940), ce qui indique que les corps cétoniques sont transportés vers le bas d'un gradient de concentration. Les mutations de perte de fonction dans MCT1 sont associées à des épisodes spontanés d'acidocétose, suggérant un rôle critique dans l'importation de corps cétoniques.
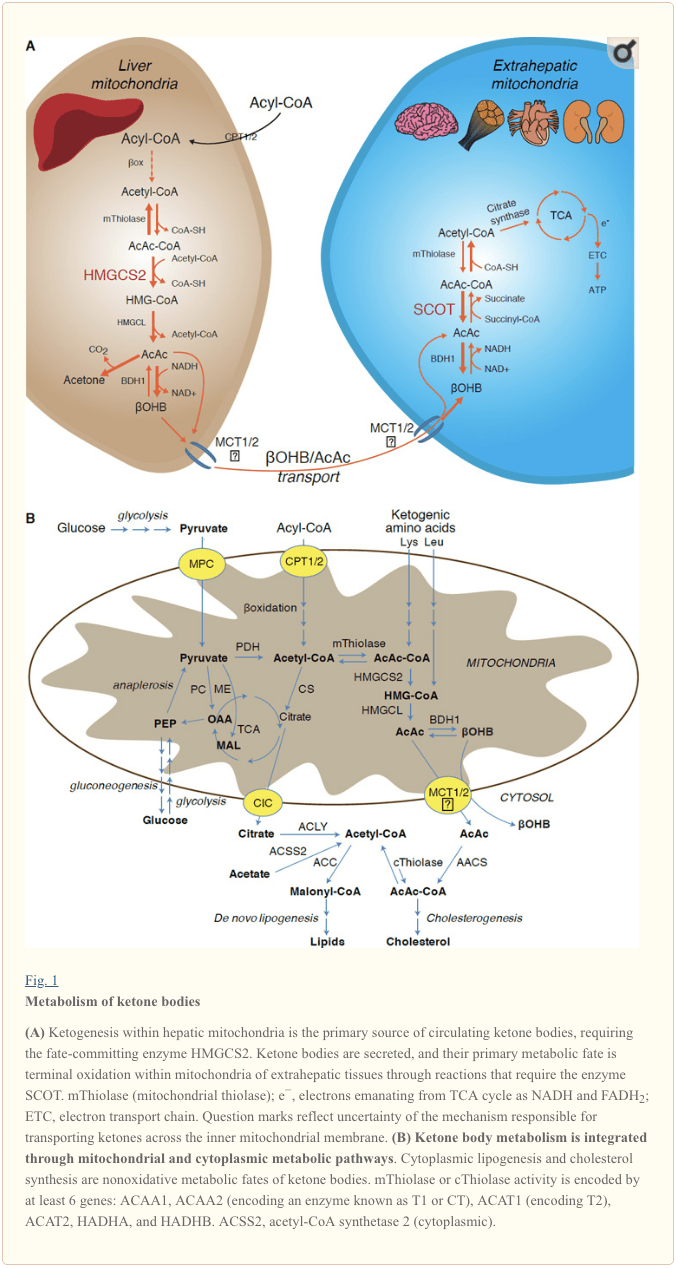
À l'exception du détournement potentiel des corps cétoniques vers des destins non oxydatifs (voir Destins métaboliques non oxydatifs des corps cétoniques), les hépatocytes n'ont pas la capacité de métaboliser les corps cétoniques qu'ils produisent. Les corps cétoniques synthétisés de novo par le foie sont (i) catabolisés dans les mitochondries des tissus extrahépatiques en acétyl-CoA, qui est disponible pour le cycle TCA pour l'oxydation terminale (Fig. 1A), (ii) détournés vers les voies de lipogenèse ou de synthèse des stérols ( Fig. 1B), ou (iii) excrété dans l'urine. En tant que carburant énergétique alternatif, les corps cétoniques sont fortement oxydés dans le cœur, les muscles squelettiques et le cerveau (Balasse et Fery, 1989 ; Bentourkia et al., 2009 ; Owen et al., 1967 ; Reichard et al., 1974 ; Sultan, 1988 ). La BDH1 mitochondriale extrahépatique catalyse la première réaction d'oxydation de l'OHB, la convertissant en AcAc de retour (LEHNINGER et al., 1960; Sandermann et al., 1986). Une d-?OHB-déshydrogénase cytoplasmique (BDH2) avec seulement 20 % d'identité de séquence avec BDH1 a un Km élevé pour les corps cétoniques et joue également un rôle dans l'homéostasie du fer (Davuluri et al., 2016 ; Guo et al., 2006) . Dans la matrice mitochondriale extrahépatique, AcAc est activé en AcAc-CoA par l'échange d'un fragment CoA à partir de succinyl-CoA dans une réaction catalysée par une transférase CoA mammifère unique, la succinyl-CoA: 3-oxoacide-CoA transférase (SCOT, CoA transférase; codé par OXCT1), par une réaction proche de l'équilibre. L'énergie libre dégagée par l'hydrolyse de l'AcAc-CoA est supérieure à celle du succinyl-CoA, favorisant la formation d'AcAc. Ainsi, le flux oxydatif des corps cétonique se produit en raison de l'action de masse : un apport abondant d'AcAc et une consommation rapide d'acétyl-CoA via la citrate synthase favorisent la formation d'AcAc-CoA (+ succinate) par SCOT. Notamment, contrairement au glucose (hexokinase) et aux acides gras (acyl-CoA synthétases), l'activation des corps cétoniques (SCOT) en une forme oxydable ne nécessite pas l'investissement d'ATP. Une réaction réversible AcAc-CoA thiolase [catalysée par l'une des quatre thiolases mitochondriales codées par ACAA2 (codant pour une enzyme connue sous le nom de T1 ou CT), ACAT1 (codant pour T2), HADHA ou HADHB] donne deux molécules d'acétyl-CoA, qui entrent dans le cycle du TCA (Hersh et Jencks, 1967 ; Stern et al., 1956 ; Williamson et al., 1971). Pendant les états cétosiques (c.-à-d. cétones sériques totales > 500 µM), les corps cétoniques deviennent des contributeurs importants à la dépense énergétique et sont rapidement utilisés dans les tissus jusqu'à ce que l'absorption ou la saturation de l'oxydation se produise (Balasse et al., 1978 ; Balasse et Fery, 1989 ; Edmond et al., 1987). Une très petite fraction des corps cétoniques dérivés du foie peut être facilement mesurée dans l'urine, et les taux d'utilisation et de réabsorption par le rein sont proportionnels à la concentration circulante (Goldstein, 1987; Robinson et Williamson, 1980). Pendant les états hautement cétosiques (> 1 mM dans le plasma), la cétonurie sert de rapporteur semi-quantitatif de la cétose, bien que la plupart des dosages cliniques des corps cétoniques urinaires détectent AcAc mais pas ?OHB (Klocker et al., 2013).
Substrats Cétogènes Et Leur Impact Sur Le Métabolisme Des Hépatocytes
Les substrats cétogènes comprennent les acides gras et les acides aminés (Fig. 1B). Le catabolisme des acides aminés, en particulier de la leucine, génère environ 4% des corps cétoniques à l'état post-absorbant (Thomas et al., 1982). Ainsi, le pool de substrats acétyl-CoA destiné à générer des corps cétoniques provient principalement d’acides gras, car lorsqu’il ya diminution de l’apport en glucides, le pyruvate pénètre dans le cycle hépatique du TCA principalement par anaplerose, c’est-à-dire une carboxylation dépendante de l’ATP en oxaloacétate (OAA) ou malate Décarboxylation non oxydative en acétyl-CoA (Jeoung et coll., 2012; Magnusson et coll., 1991; Merritt et coll., 2011). Dans le foie, le glucose et le pyruvate contribuent de façon négligeable à la cétogenèse, même lorsque la décarboxylation du pyruvate en acétyl-CoA est maximale (Jeoung et al., 2012).
L'acétyl-CoA englobe plusieurs rôles essentiels au métabolisme intermédiaire hépatique au-delà de la génération d'ATP via l'oxydation terminale (voir également Intégration du métabolisme du corps cétone, de la modification post-traductionnelle et de la physiologie cellulaire). Acétyl-CoA active allostériquement (i) la pyruvate carboxylase (PC), activant ainsi un mécanisme de contrôle métabolique augmentant l'entrée anaplérotique de métabolites dans le cycle du TCA (Owen et coll., 2002; Scrutton et Utter, 1967) et (ii) pyruvate déshydrogénase. kinase, qui phosphoryle et inhibe la pyruvate déshydrogénase (PDH) (Cooper et al., 1975), améliorant ainsi le flux de pyruvate dans le cycle du TCA via l'anaplerose. De plus, l'acétyl-CoA cytoplasmique, dont le pool est augmenté par des mécanismes qui convertissent l'acétyl-CoA mitochondrial en métabolites transportables, inhibe l'oxydation des acides gras: l'acétyl-CoA carboxylase (ACC) catalyse la conversion de l'acétyl-CoA en malonyl-CoA, le substrat lipogène. et un inhibiteur allostérique de CPT1 mitochondrial [examiné dans (Kahn et al., 2005; McGarry et Foster, 1980)]. Ainsi, le pool acétyl-CoA mitochondrial régule et est régulé par la voie de débordement de la cétogenèse, qui orchestre les principaux aspects du métabolisme intermédiaire hépatique.
Destins métaboliques non oxydants des corps cétoniques
Le destin prédominant des cétones dérivés du foie est l’oxydation extrahépatique dépendant de SCOT. Cependant, AcAc peut être exporté des mitochondries et utilisé dans les voies anaboliques par conversion en AcAc-CoA par une réaction dépendante de l'ATP catalysée par l'acétoacétyl-CoA synthétase cytoplasmique (AACS, Fig. 1B). Cette voie est active pendant le développement du cerveau et dans la glande mammaire en lactation (Morris, 2005; Robinson et Williamson, 1978; Ohgami et al., 2003). Les AACS sont également fortement exprimés dans les tissus adipeux et les ostéoclastes activés (Aguilo et al., 2010; Yamasaki et al., 2016). L'AcAc-CoA cytoplasmique peut être dirigé par le HMGCS1 cytosolique vers la biosynthèse des stérols, ou clivé par l'un de deux thiolases cytoplasmiques en acétyl-CoA (ACAA1 et ACAT2), carboxylé en malonyl-CoA et contribuer à la synthèse d'acides gras al., 1984; Edmond, 1974; Endemann et al., 1982; Geelen et al., 1983; Webber et Edmond, 1977).
Bien que la signification physiologique reste à établir, les cétones peuvent servir de substrats anabolisants même dans le foie. Dans des contextes expérimentaux artificiels, l'AcAc peut contribuer jusqu'à la moitié des lipides nouvellement synthétisés et jusqu'à 75 % du nouveau cholestérol synthétisé (Endemann et al., 1982 ; Geelen et al., 1983 ; Freed et al., 1988). Étant donné que l'AcAc est dérivé d'une oxydation incomplète des graisses hépatiques, la capacité de l'AcAc à contribuer à la lipogenèse in vivo impliquerait un cycle hépatique futile, où les cétones dérivées des graisses peuvent être utilisées pour la production de lipides, une notion dont la signification physiologique nécessite une validation expérimentale, mais pourrait servir rôles adaptatifs ou inadaptés (Solinas et al., 2015). L'AcAc fournit avidement la cholestérogénèse, avec un faible AACS Km-AcAc (~ 50 µM) favorisant l'activation de l'AcAc même à l'état nourri (Bergstrom et al., 1984). Le rôle dynamique du métabolisme des cétones cytoplasmiques a été suggéré dans les neurones embryonnaires primaires de souris et dans les adipocytes dérivés de 3T3-L1, car l'inactivation de l'AACS altère la différenciation de chaque type de cellule (Hasegawa et al., 2012a; Hasegawa et al., 2012b). La suppression de l'AACS chez la souris in vivo a diminué le cholestérol sérique (Hasegawa et al., 2012c). SREBP-2, un régulateur transcriptionnel maître de la biosynthèse du cholestérol et un récepteur activé par les proliférateurs de peroxysomes (PPAR)-? sont des activateurs transcriptionnels AACS et régulent sa transcription pendant le développement des neurites et dans le foie (Aguilo et al., 2010; Hasegawa et al., 2012c). Pris ensemble, le métabolisme des corps cétoniques cytoplasmiques peut être important dans certaines conditions ou histoires naturelles de maladies, mais ne permet pas d'éliminer les corps cétoniques dérivés du foie, car une hypercétonémie massive se produit dans le cadre d'une altération sélective du destin oxydatif primaire via des mutations de perte de fonction. au SCOT (Berry et al., 2001 ; Cotter et al., 2011).
Régulation de HMGCS2 et SCOT / OXCT1
La divergence d'un mitochondrial par rapport au gène codant pour l'HMGCS cytosolique s'est produite tôt dans l'évolution des vertébrés en raison de la nécessité de soutenir la cétogenèse hépatique chez les espèces présentant des ratios poids corporel plus élevés (Boukaftane et al., 1994; Cunnane et Crawford, 2003). Des mutations naturellement rares de HMGCS2 avec perte de fonction chez l'homme provoquent des épisodes d'hypoglycémie hypocétotique (Pitt et coll., 2015; Thompson et coll., 1997). L'expression robuste de HMGCS2 est limitée aux hépatocytes et à l'épithélium colique. Son expression et son activité enzymatique sont coordonnées par divers mécanismes (Mascaro et al., 1995; McGarry et Foster, 1980; Robinson et Williamson, 1980). Bien que l’ensemble des états physiologiques qui influent sur HMGCS2 nécessitent une élucidation plus poussée, son expression et / ou son activité est régulée au cours de la période postnatale précoce, du vieillissement, du diabète, de la famine ou de l’ingestion d’un régime cétogène (Balasse et Fery, 1989; Cahill GF Jr, 2006). ; Girard et al., 1992; Hegardt, 1999; Satapati et al., 2012; Sengupta et al., 2010). Chez le fœtus, la méthylation de la région adjacente du gène Hmgcs5 de 2 est inversement corrélée à sa transcription et est partiellement inversée après la naissance (Arias et coll., 1995; Ayte et coll., 1993; Ehara et coll., 2015; Ferre et coll. ., 1983). De même, Bdh1 hépatique présente un schéma d'expression développemental, croissant de la naissance au sevrage, et est également induite par le régime cétogène dans une dépendance du facteur de croissance du fibroblaste (FGF) -21 (Badman et al., 2007; Zhang et al., 1989 ). La cétogenèse chez les mammifères est très sensible à l'insuline et au glucagon, étant supprimée et stimulée, respectivement (McGarry et Foster, 1977). L'insuline supprime la lipolyse des tissus adipeux, privant ainsi la cétogenèse de son substrat, tandis que le glucagon augmente le flux cétogène par un effet direct sur le foie (Hegardt, 1999). La transcription de Hmgcs2 est stimulée par le facteur de transcription Forkhead FOXA2, inhibé via la signalisation insuline-phosphatidylinositol-3-kinase / Akt, et induite par la signalisation glucagon-cAMP-p300 (Arias et al., 1995; Hegardt, 1999; X et 1990; Quant et al. 1993; Thumelin et al., 2013; von Meyenn et al., 2004; Wolfrum et al., 2003; Wolfrum et al., XNUMX). PARA ? (Rodriguez et al., 1994) avec sa cible, le FGF21 (Badman et al., 2007) induit également la transcription du Hmgcs2 dans le foie pendant la famine ou l'administration d'un régime cétogène (Badman et al., 2007; Inagaki et al., 2007) ). Induction de PPAR? peut survenir avant la transition de la physiologie fœtale à la physiologie néonatale, tandis que l'activation du FGF21 peut être favorisée au début de la période néonatale via l'inhibition de l'histone désacétylase (HDAC) -3 médiée par? OHB (Rando et al., 2016). mTORC1 (cible mammifère du complexe de rapamycine 1) inhibition dépendante de PPAR L'activité transcriptionnelle est également un régulateur clé de l'expression du gène Hmgcs2 (Sengupta et al., 2010), et le foie PER2, un maître oscillateur circadien, régule indirectement l'expression du Hmgcs2 (Chavan et al., 2016). Des observations récentes indiquent que l'interleukine-6 induite par une tumeur extrahépatique altère la cétogenèse via PPAR? suppression (Flint et al., 2016).
L'activité de l'enzyme HMGCS2 est régulée par plusieurs PTM. La phosphorylation de la serine HMGCS2 a augmenté son activité in vitro (Grimsrud et al., 2012). L'activité de HMGCS2 est inhibée de manière allostérique par la succinylation de résidus de lysine et de succinyl-CoA (Arias et coll., 1995; Hegardt, 1999; Lowe et Tubbs, 1985; Quant et coll., 1990; Rardin et coll., 2013; 1975; Reed et coll. 1993; Thumelin et al., 2). La succinylation des résidus lysine HMGCS1, HMGCL et BDH5 dans les mitochondries hépatiques est une cible de la sirtuine déshérylase 5 (SIRT2013) dépendante de NAD + (Rardin et al., 2). L'activité de HMGCS3 est également améliorée par la désacétylation de la lysine de SIRT2 et il est possible qu'une diaphonie entre l'acétylation et la succinylation régule l'activité de HMGCS2013 (Rardin et coll., 2013; Shimazu et coll., 2). Malgré la capacité de ces PTM à réguler HMGCSXNUMX Km et Vmax, les fluctuations de ces PTM n’ont pas encore été cartographiées avec précision ni confirmées en tant que facteurs mécanistes de la cétogenèse in vivo.
Le SCOT est exprimé dans toutes les cellules de mammifères porteuses de mitochondries, à l'exception de celles d'hépatocytes. L'importance de l'activité SCOT et de la cétolyse a été démontrée chez les souris SCOT-KO, qui présentaient une létalité uniforme en raison d'une hypoglycémie hypercétémique dans 48h après la naissance (Cotter et al., 2011). La perte de SCOT spécifique des tissus dans les neurones ou les myocytes squelettiques induit des anomalies métaboliques pendant la famine mais n'est pas mortelle (Cotter et al., 2013b). Chez les humains, le déficit en SCOT se manifeste tôt dans la vie avec une acidocétose grave, provoquant léthargie, vomissements et coma (Berry et coll., 2001; Fukao et coll., 2000; Kassovska-Bratinova et coll., 1996, Niezen-Koning et coll. , 1997; Saudubray et al., 1987; Snyderman et al., 1998; Tildon et Cornblath, 1972). On en sait relativement peu au niveau cellulaire sur les régulateurs de l’expression du gène SCOT et des protéines. L’expression de l’ARNm et la protéine SCOT d’Oxct1 sont diminuées dans les états cétotiques, peut-être par le biais de mécanismes dépendants du PPAR (Fenselau et Wallis, 1974; Fenselau et Wallis, 1976; Grinblat et al., 1986; Okuda et al., 1991; Turko et al. ., 2001; Wentz et al., 2010). Dans l'acidocétose diabétique, l'inadéquation entre la cétogenèse hépatique et l'oxydation extrahépatique est exacerbée par une altération de l'activité du SCOT. La surexpression du transporteur de glucose indépendant de l'insuline (GLUT1 / SLC2A1) dans les cardiomyocytes inhibe également l'expression du gène Oxct1 et régule à la baisse l'oxydation terminale des cétones dans un état non cétotique (Yan et al., 2009). Au niveau du foie, l'abondance d'ARNm d'Oxct1 est réduite par le H122KXNXXXXXXXXX de microRNA-3 et par l'histone, qui sont évidentes lors du passage de la période fœtale à la période néonatale (Thorrez et al., 27). Cependant, la suppression de l’expression hépatique d’Oxct3 au cours de la période postnatale est principalement imputable à l’évacuation des progéniteurs hématopoïétiques exprimant Oxct2011 du foie, plutôt qu’à une perte de l’expression existante d’Oxct1 dans des hépatocytes différenciés de manière terminale. En fait, l'expression de l'ARNm et de la protéine SCOT d'Oxct1 dans des hépatocytes différenciés est extrêmement faible (Orii et al., 1).
SCOT est également réglementé par les PTM. L'enzyme est hyperacétylée dans le cerveau des souris SIRT3 KO, qui présentent également une production diminuée d'acétyl-CoA dépendante de l'AcAc (Dittenhafer-Reed et al., 2015). La nitration non enzymatique des résidus de tyrosine de SCOT atténue également son activité, qui a été rapportée dans les coeurs de divers modèles de souris diabétiques (Marcondes et coll., 2001; Turko et coll., 2001; Wang et coll., 2010a). En revanche, la nitration des résidus de tryptophane augmente l'activité de SCOT (Brégère et al., 2010; Rebrin et al., 2007). Des mécanismes moléculaires de nitration ou de dénitration spécifiques aux résidus, conçus pour moduler l'activité de SCOT, peuvent exister et nécessiter une élucidation.
Controverses dans la cétogenèse extrahépatique
Chez les mammifères, le principal organe cétogène est le foie, et seuls les hépatocytes et les cellules épithéliales intestinales expriment abondamment l'isoforme mitochondriale de HMGCS2 (Cotter et al., 2013a ; Cotter et al., 2014 ; McGarry et Foster, 1980 ; Robinson et Williamson, 1980) . La fermentation bactérienne anaérobie de polysaccharides complexes produit du butyrate, qui est absorbé par les colonocytes chez les mammifères pour l'oxydation terminale ou la cétogenèse (Cherbuy et al., 1995), qui peut jouer un rôle dans la différenciation des colonocytes (Wang et al., 2016). À l'exclusion des cellules épithéliales intestinales et des hépatocytes, HMGCS2 est presque absent dans presque toutes les autres cellules de mammifères, mais la perspective d'une cétogenèse extrahépatique a été évoquée dans les cellules tumorales, les astrocytes du système nerveux central, le rein, le pancréas ? pigmentaire rétinien (EPR) et même dans le muscle squelettique (Adijanto et al., 2014 ; Avogaro et al., 1992 ; El Azzouny et al., 2016 ; Grabacka et al., 2016 ; Kang et al., 2015 ; Le Foll et al., 2014 ; Nonaka et al., 2016 ; Takagi et al., 2016a ; Thevenet et al., 2016 ; Zhang et al., 2011). Le HMGCS2 ectopique a été observé dans des tissus dépourvus de capacité cétogène nette (Cook et al., 2016; Wentz et al., 2010), et le HMGCS2 présente des activités prospectives de « clair de lune » indépendantes de la cétogenèse, y compris au sein du noyau cellulaire (Chen et al. , 2016 ; Kostiuk et al., 2010 ; Meertens et al., 1998).
Tout tissu extrahépatique qui oxyde les corps cétoniques a également le potentiel d'accumuler des corps cétoniques via des mécanismes indépendants de HMGCS2 (Fig. 2A). Cependant, il n'y a pas de tissu extrahépatique dans lequel une concentration corporelle cétonique à l'état d'équilibre dépasse celle de la circulation (Cotter et al., 2011; Cotter et al., 2013b; Harrison et Long, 1940), ce qui souligne que les corps cétoniques sont transportés dans un gradient de concentration via des mécanismes dépendant de MCT1 / 2. Un mécanisme de cétogenèse extrahépatique apparente peut en fait refléter une altération relative de l'oxydation de la cétone. D'autres explications potentielles relèvent du domaine de la formation du corps cétonique. Premièrement, la cétogenèse de novo peut se produire via l'activité enzymatique réversible de la thiolase et du SCOT (Weidemann et Krebs, 1969). Lorsque la concentration d'acétyl-CoA est relativement élevée, les réactions normalement responsables de l'oxydation de l'AcAc fonctionnent dans le sens inverse (GOLDMAN, 1954). Un deuxième mécanisme se produit lorsque les intermédiaires dérivés de la ß-oxydation s'accumulent en raison d'un goulot d'étranglement du cycle TCA, AcAc-CoA est converti en l-? OHB-CoA par une réaction catalysée par la 3-hydroxyacyl-CoA déshydrogénase mitochondriale, et en outre par la 3-hydroxybutyryl La CoA désacylase en l-? OHB, qui ne peut être distinguée par spectrométrie de masse ou spectroscopie de résonance de l'énantiomère physiologique d-? OHB (Reed et Ozand, 1980). Le l-? OHB peut être distingué chromatographiquement ou enzymatiquement du d-? OHB et est présent dans les tissus extra-hépatiques, mais pas dans le foie ou le sang (Hsu et al., 2011). La cétogenèse hépatique ne produit que du d-? OHB, le seul énantiomère qui est un substrat BDH (Ito et al., 1984; Lincoln et al., 1987; Reed et Ozand, 1980; Scofield et al., 1982; Scofield et al., 1982). Un troisième mécanisme indépendant de HMGCS2 génère le d-? OHB par catabolisme des acides aminés, en particulier celui de la leucine et de la lysine. Un quatrième mécanisme n'apparaît que parce qu'il est dû à un artefact de marquage et est donc appelé pseudocétogenèse. Ce phénomène est attribuable à la réversibilité des réactions SCOT et thiolase, et peut entraîner une surestimation du renouvellement du corps cétonique en raison de la dilution isotopique du traceur corporel cétonique dans les tissus extra-hépatiques (Des Rosiers et al., 1990; Fink et al., 1988) . Néanmoins, la pseudocétogenèse peut être négligeable dans la plupart des contextes (Bailey et al., 1990; Keller et al., 1978). Un schéma (figure 2A) indique une approche utile à appliquer tout en considérant une concentration élevée de tissu à l'état d'équilibre de cétones.
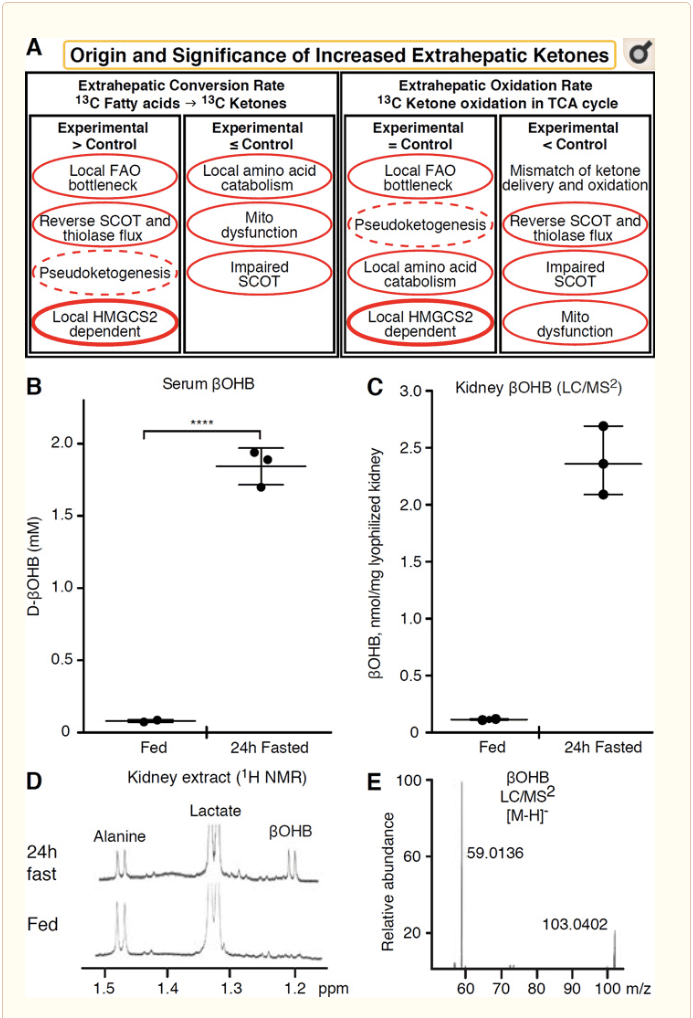

Le rein a récemment retenu l'attention en tant qu'organe potentiellement cétogène. Dans la grande majorité des États, le rein est un consommateur net de corps cétoniques dérivés du foie, excrétant ou réabsorbant les corps cétoniques de la circulation sanguine, et le rein n'est généralement pas un générateur ou un concentrateur net de corps cétoniques (Robinson et Williamson, 1980). Les auteurs d'une étude classique ont conclu que la cétogenèse rénale minimale quantifiée dans un système expérimental artificiel n'était pas physiologiquement pertinente (Weidemann et Krebs, 1969). Récemment, la cétogenèse rénale a été déduite dans des modèles de souris diabétiques et déficientes en autophagie, mais il est plus probable que des changements multi-organes dans l'homéostasie métabolique modifient le métabolisme intégratif des cétones par des entrées sur plusieurs organes (Takagi et al., 2016a; Takagi et al., 2016b ; Zhang et al., 2011). Une publication récente a suggéré que la cétogenèse rénale était un mécanisme de protection contre les lésions d'ischémie-reperfusion dans le rein (Tran et al., 2016). Des concentrations absolues à l'état d'équilibre de ?OHB à partir d'extraits de tissu rénal de souris ont été rapportées à environ 4–12 mM. Pour tester si cela était tenable, nous avons quantifié les concentrations de ?OHB dans des extraits rénaux de souris nourries et à jeun 24h. Les concentrations sériques de ?OHB sont passées d'environ 100 μM à 2 mM avec un jeûne de 24 h (Fig. 2B), tandis que les concentrations rénales d'OHB à l'état d'équilibre sont d'environ 100 μM à jeun et de seulement 1 mM à jeun de 24 h (Fig. 2C– E), des observations cohérentes avec des concentrations quantifiées il y a plus de 45 ans (Hems et Brosnan, 1970). Il reste possible que dans les états cétosiques, les corps cétoniques dérivés du foie puissent être rénoprotecteurs, mais les preuves de la cétogenèse rénale nécessitent une justification supplémentaire. Des preuves convaincantes à l'appui d'une véritable cétogenèse extrahépatique ont été présentées dans RPE (Adijanto et al., 2014). Cette transformation métabolique intrigante a été suggérée pour permettre potentiellement aux cétones dérivées de RPE de s'écouler vers les photorécepteurs ou les cellules gliales de Müller, ce qui pourrait aider à la régénération du segment externe du photorécepteur.
? OHB comme médiateur de signalisation
Bien qu'ils soient énergétiquement riches, les corps cétoniques exercent des rôles de signalisation « non canoniques » provocateurs dans l'homéostasie cellulaire (Fig. 3) (Newman et Verdin, 2014 ; Rojas-Morales et al., 2016). Par exemple, ?OHB inhibe les HDAC de classe I, ce qui augmente l'acétylation des histones et induit ainsi l'expression de gènes qui réduisent le stress oxydatif (Shimazu et al., 2013). ?OHB lui-même est un modificateur covalent d'histone au niveau des résidus de lysine dans le foie de souris diabétiques à jeun ou induites par la streptozotocine (Xie et al., 2016) (voir également ci-dessous, L'intégration du métabolisme des corps cétoniques, de la modification post-traductionnelle et de la physiologie cellulaire, et Corps cétoniques, stress oxydatif et neuroprotection).
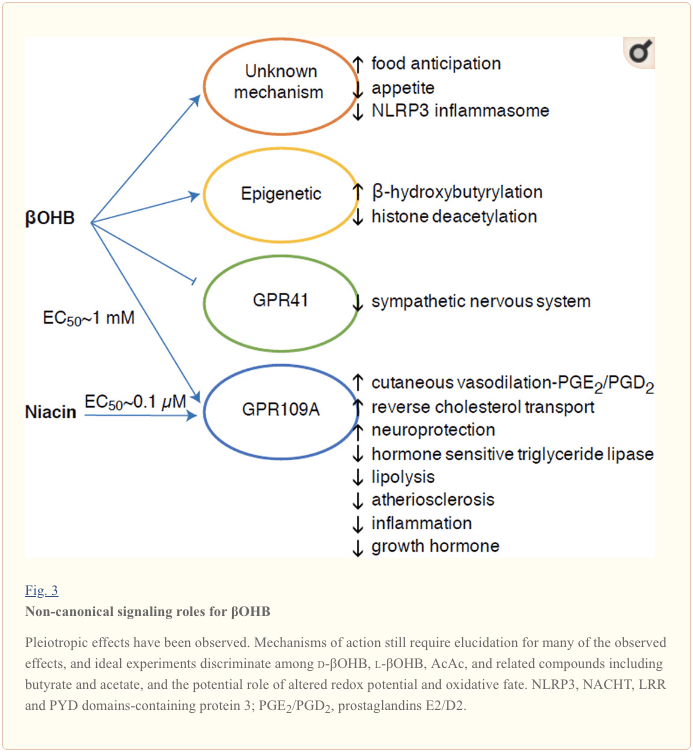
?OHB est également un effecteur via les récepteurs couplés aux protéines G. Grâce à des mécanismes moléculaires peu clairs, il supprime l'activité du système nerveux sympathique et réduit la dépense énergétique totale et la fréquence cardiaque en inhibant la signalisation des acides gras à chaîne courte par le récepteur 41 couplé aux protéines G (GPR41) (Kimura et al., 2011). L'un des effets de signalisation les plus étudiés de ?OHB passe par GPR109A (également connu sous le nom de HCAR2), un membre de la sous-famille des acides hydrocarboxyliques GPCR exprimé dans les tissus adipeux (blanc et brun) (Tunaru et al., 2003), et dans cellules immunitaires (Ahmed et al., 2009). ?OHB est le seul ligand endogène connu du récepteur GPR109A (EC50 ~770 µM) activé par d-?OHB, l-?OHB et butyrate, mais pas AcAc (Taggart et al., 2005). Le seuil de concentration élevé pour l'activation de GPR109A est atteint par l'adhésion à un régime cétogène, la famine ou pendant l'acidocétose, conduisant à l'inhibition de la lipolyse du tissu adipeux. L'effet anti-lipolytique du GPR109A passe par l'inhibition de l'adénylylcyclase et la diminution de l'AMPc, inhibant la triglycéride lipase sensible aux hormones (Ahmed et al., 2009 ; Tunaru et al., 2003). Cela crée une boucle de rétroaction négative dans laquelle la cétose constitue un frein modulateur à la cétogenèse en diminuant la libération d'acides gras non estérifiés par les adipocytes (Ahmed et al., 2009 ; Taggart et al., 2005), effet qui peut être contrebalancé par la pulsion sympathique qui stimule la lipolyse. La niacine (vitamine B3, acide nicotinique) est un puissant ligand (EC50 ~ 0.1 µM) du GRP109A, utilisé efficacement depuis des décennies pour les dyslipidémies (Benyo et al., 2005 ; Benyo et al., 2006 ; Fabbrini et al., 2010a ; Lukasova et al., 2011 ; Tunaru et al., 2003). Alors que la niacine améliore le transport inverse du cholestérol dans les macrophages et réduit les lésions athérosclérotiques (Lukasova et al., 2011), les effets de l'OHB sur les lésions athérosclérotiques restent inconnus. Bien que le récepteur GPR109A exerce un rôle protecteur et qu'il existe des liens intrigants entre l'utilisation d'un régime cétogène dans les accidents vasculaires cérébraux et les maladies neurodégénératives (Fu et al., 2015; Rahman et al., 2014), un rôle protecteur de ?OHB via GPR109A n'a pas été démontré in vivo .
Enfin, l'OHB peut influencer l'appétit et la satiété. Une méta-analyse d'études mesurant les effets des régimes cétogènes et à très faible énergie a conclu que les participants consommant ces régimes présentent une satiété plus élevée que les régimes témoins (Gibson et al., 2015). Cependant, une explication plausible de cet effet est les éléments métaboliques ou hormonaux supplémentaires qui pourraient moduler l'appétit. Par exemple, les souris soumises à un régime cétogène pour rongeurs ont présenté une dépense énergétique accrue par rapport aux souris nourries avec des aliments témoins, malgré un apport calorique similaire, et la leptine en circulation ou les gènes de peptides régulant le comportement alimentaire n'ont pas été modifiés (Kennedy et al., 2007). Parmi les mécanismes proposés qui suggèrent la suppression de l'appétit par? OHB comprend à la fois la signalisation et l'oxydation (Laeger et al., 2010). Des études sur la suppression spécifique des hépatocytes du gène du rythme circadien (Per2) et l'immunoprécipitation de la chromatine ont révélé que PER2 active directement le gène Cpt1a et régule indirectement Hmgcs2, conduisant à une cétose altérée chez les souris knock-out Per2 (Chavan et al., 2016). Ces souris présentaient une altération de l'anticipation alimentaire, qui a été partiellement restaurée par l'administration systémique de? OHB. Des études futures seront nécessaires pour confirmer le système nerveux central en tant que cible directe de l'OHB, et si l'oxydation de la cétone est nécessaire pour les effets observés, ou si un autre mécanisme de signalisation est impliqué. D'autres chercheurs ont invoqué la possibilité d'une cétogenèse locale dérivée des astrocytes dans l'hypothalamus ventromédial comme régulateur de la prise alimentaire, mais ces observations préliminaires bénéficieront également d'évaluations génétiques et basées sur les flux (Le Foll et al., 2014). La relation entre la cétose et la privation de nutriments reste intéressante car la faim et la satiété sont des éléments importants dans les tentatives infructueuses de perte de poids.
Intégration du métabolisme du corps cétonique, de la modification post-traductionnelle et de la physiologie cellulaire
Les corps cétoniques contribuent aux pools compartimentés d'acétyl-CoA, un intermédiaire clé qui joue un rôle important dans le métabolisme cellulaire (Pietrocola et al., 2015). L’un des rôles de l’acétyl-CoA est de servir de substrat à l’acétylation, une modification covalente de l’histone catalysée enzymatiquement (Choudhary et coll., 2014; Dutta et coll., 2016; Fan et coll., 2015; Menzies et coll., 2016 ). Un grand nombre de protéines mitochondriales à acétyle dynamique, dont beaucoup peuvent résulter de mécanismes non enzymatiques, ont également émergé d'études protéomiques computationnelles (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al., 2013 ; Shimazu et al., 2010). Les lysine désacétylases utilisent un cofacteur de zinc (par exemple, des HDAC nucléocytosoliques) ou du NAD + comme co-substrat (sirtuines, SIRT) (Choudhary et coll., 2014; Menzies et coll., 2016). L'acétylprotéome sert à la fois de capteur et d'effecteur du pool cellulaire total d'acétyl-CoA, les manipulations physiologiques et génétiques entraînant chacune des variations non enzymatiques de l'acétylation (Weinert et al., 2014). Les métabolites intracellulaires servant de modulateurs de l'acétylation des résidus de lysine, il est important de prendre en compte le rôle des corps cétoniques, dont l'abondance est très dynamique.
? OHB est un modificateur épigénétique par au moins deux mécanismes. L'augmentation des taux de? OHB induite par le jeûne, la restriction calorique, l'administration directe ou l'exercice prolongé provoquent une inhibition de l'HDAC ou une activation de l'histone acétyltransférase (Marosi et al., 2016; Sleiman et al., 2016) ou au stress oxydatif (Shimazu et al., 2013) . L'inhibition de l'OHB de HDAC3 pourrait réguler la physiologie métabolique du nouveau-né (Rando et al., 2016). Indépendamment,? OHB lui-même modifie directement les résidus de lysine d'histone (Xie et al., 2016). Un jeûne prolongé ou une acidocétose diabétique induite par la steptozotocine a augmenté la ß -hydroxybutyrylation d'histone. Bien que le nombre de sites de lysine ß -hydroxybutyrylation et d'acétylation soit comparable, une histone ß -hydroxybutyrylation stoechiométrique plus élevée que l'acétylation a été observée. Des gènes distincts ont été affectés par l'histone lysine ß -hydroxybutyrylation, par rapport à l'acétylation ou à la méthylation, suggérant des fonctions cellulaires distinctes. On ne sait pas si la ß-hydroxybutyrylation est spontanée ou enzymatique, mais élargit la gamme de mécanismes à travers les corps cétoniques qui influencent dynamiquement la transcription.
Les événements essentiels de reprogrammation cellulaire au cours de la restriction calorique et de la privation de nutriments peuvent être médiés dans la désacétylation et la désuccinylation mitochondriale dépendante de SIRT3 et SIRT5, respectivement, régulant les protéines cétogènes et cétolytiques au niveau post-traductionnel dans le foie et les tissus extrahépatiques (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al., 2013; Shimazu et al., 2010). Bien que la comparaison stoechiométrique des sites occupés ne soit pas nécessairement directement liée aux changements du flux métabolique, l'acétylation mitochondriale est dynamique et peut être déterminée par la concentration d'acétyl-CoA ou le pH mitochondrial, plutôt que par les acétyltransférases enzymatiques (Wagner et Payne, 2013). Le fait que SIRT3 et SIRT5 modulent les activités des enzymes métabolisant le corps cétonique pose la question du rôle réciproque des cétones dans la sculpture de l'acétylprotéome, du succinylprotéome et d'autres cibles cellulaires dynamiques. En effet, comme les variations de la cétogenèse reflètent les concentrations de NAD +, la production et l'abondance de la cétone pourraient réguler l'activité de la sirtuine, influençant ainsi les pools totaux d'acétyl-CoA / succinyl-CoA, l'acylprotéome et donc la physiologie mitochondriale et cellulaire. La ß-hydroxybutyrylation des résidus de l'enzyme lysine pourrait ajouter une autre couche à la reprogrammation cellulaire. Dans les tissus extrahépatiques, l'oxydation du corps cétonique peut stimuler des modifications analogues de l'homéostasie cellulaire. Alors que la compartimentation des pools d'acétyl-CoA est hautement régulée et coordonne un large spectre de changements cellulaires, la capacité des corps cétoniques à façonner directement les concentrations d'acétyl-CoA mitochondrial et cytoplasmique doit être élucidée (Chen et al., 2012; Corbet et al., 2016; Pougovkina et al., 2014; Schwer et al., 2009; Wellen et Thompson, 2012). Étant donné que les concentrations d'acétyl-CoA sont étroitement régulées et que l'acétyl-CoA est imperméable à la membrane, il est essentiel de prendre en compte les mécanismes de pilotage coordonnant l'homéostasie de l'acétyl-CoA, y compris les taux de production et d'oxydation terminale dans le cycle du TCA, la conversion en corps cétoniques, mitochondrial efflux via la carnitine acétyltransférase (CrAT) ou l'exportation d'acétyl-CoA vers le cytosol après conversion en citrate et libération par l'ATP citrate lyase (ACLY). Les rôles clés de ces derniers mécanismes dans l'acétylprotéome cellulaire et l'homéostasie nécessitent une compréhension correspondante des rôles de la cétogenèse et de l'oxydation des cétones (Das et al., 2015; McDonnell et al., 2016; Moussaieff et al., 2015; Overmyer et al., 2015; Seiler et al., 2014; Seiler et al., 2015; Wellen et al., 2009; Wellen et Thompson, 2012). Des technologies convergentes de métabolomique et d'acylprotéomique dans le cadre de modèles génétiquement manipulés seront nécessaires pour spécifier les objectifs et les résultats.
Réponses anti-inflammatoires et pro-inflammatoires des corps cétoniques
La cétose et les corps cétoniques modulent l'inflammation et la fonction des cellules immunitaires, mais des mécanismes variés et même discordants ont été proposés. La privation prolongée de nutriments réduit l'inflammation (Youm et al., 2015), mais la cétose chronique du diabète de type 1 est un état pro-inflammatoire (Jain et al., 2002; Kanikarla-Marie et Jain, 2015; Kurepa et al., 2012) ). Des rôles de signalisation basés sur des mécanismes pour ßOHB dans l'inflammation apparaissent parce que de nombreuses cellules du système immunitaire, y compris les macrophages ou les monocytes, expriment abondamment GPR109A. Alors que l'OHB exerce une réponse principalement anti-inflammatoire (Fu et al., 2014; Gambhir et al., 2012; Rahman et al., 2014; Youm et al., 2015), des concentrations élevées de corps cétoniques, en particulier AcAc, peuvent déclencher une réponse pro-inflammatoire (Jain et al., 2002; Kanikarla-Marie et Jain, 2015; Kurepa et al., 2012).
Les rôles anti-inflammatoires des ligands GPR109A dans l'athérosclérose, l'obésité, les maladies inflammatoires de l'intestin, les maladies neurologiques et le cancer ont été examinés (Graff et al., 2016). L'expression de GPR109A est augmentée dans les cellules RPE de modèles diabétiques, de patients diabétiques humains (Gambhir et al., 2012) et dans la microglie pendant la neurodégénérescence (Fu et al., 2014). Les effets anti-inflammatoires de la? OHB sont renforcés par la surexpression de GPR109A dans les cellules RPE et abrogés par l'inhibition pharmacologique ou le knock-out génétique du GPR109A (Gambhir et al., 2012). ? OHB et acide nicotinique exogène (Taggart et al., 2005), tous deux confèrent des effets anti-inflammatoires au TNF? ou inflammation induite par le LPS en diminuant les taux de protéines pro-inflammatoires (iNOS, COX-2) ou de cytokines sécrétées (TNF ™, IL-1 ™, IL-6, CCL2 / MCP-1), en partie par l'inhibition de la NF - translocation? B (Fu et al., 2014; Gambhir et al., 2012). «OHB diminue le stress ER et l'inflammasome NLRP3, activant la réponse au stress antioxydant (Bae et al., 2016; Youm et al., 2015). Cependant, dans l'inflammation neurodégénérative, la protection médiée par la? OHB dépendante de GPR109A n'implique pas de médiateurs inflammatoires comme la signalisation de la voie MAPK (par exemple, ERK, JNK, p38) (Fu et al., 2014), mais peut nécessiter une PGD1 dépendante de la COX-2 production (Rahman et al., 2014). Il est fascinant que le macrophage GPR109A soit nécessaire pour exercer un effet neuroprotecteur dans un modèle d'accident ischémique cérébral (Rahman et al., 2014), mais la capacité de? OHB à inhiber l'inflammasome NLRP3 dans les macrophages dérivés de la moelle osseuse est indépendante du GPR109A (Youm et al. ., 2015). Bien que la plupart des études établissent un lien entre l'OHB et les effets anti-inflammatoires, l'OHB peut être pro-inflammatoire et augmenter les marqueurs de la peroxydation lipidique dans les hépatocytes de veau (Shi et al., 2014). Les effets anti-inflammatoires versus pro-inflammatoires de l 'OHB peuvent donc dépendre du type de cellule, de la concentration de l' OHB, de la durée d'exposition et de la présence ou de l'absence de co-modulateurs.
Contrairement à? OHB, AcAc peut activer la signalisation pro-inflammatoire. Un AcAc élevé, en particulier avec une concentration élevée de glucose, intensifie les lésions des cellules endothéliales par le biais d'un mécanisme dépendant de la NADPH oxydase / stress oxydatif (Kanikarla-Marie et Jain, 2015). Des concentrations élevées d'AcAc dans le cordon ombilical des mères diabétiques étaient corrélées à un taux d'oxydation des protéines et à une concentration de MCP-1 plus élevés (Kurepa et al., 2012). Un AcAc élevé chez les patients diabétiques était-il corrélé au TNF? expression (Jain et al., 2002), et AcAc, mais pas? OHB, induit le TNF ?, l'expression du MCP-1, l'accumulation de ROS et la diminution du taux d'AMPc dans les cellules monocytes humaines U937 (Jain et al., 2002; Kurepa et al. ., 2012).
Les phénomènes de signalisation dépendant du corps cétonique sont fréquemment déclenchés uniquement avec des concentrations corporelles cétoniques élevées (> 5 mM), et dans le cas de nombreuses études liant les cétones à des effets pro ou anti-inflammatoires, par des mécanismes peu clairs. De plus, en raison des effets contradictoires de? OHB versus AcAc sur l'inflammation, et de la capacité du rapport AcAc /? OHB à influencer le potentiel redox mitochondrial, les meilleures expériences évaluant les rôles des corps cétoniques sur les phénotypes cellulaires comparent les effets de AcAc et? OHB dans des proportions variables et à des concentrations cumulatives variables [p. Ex. (Saito et al., 2016)]. Enfin, AcAc peut être acheté dans le commerce uniquement sous forme de sel de lithium ou d'ester éthylique qui nécessite une hydrolyse de base avant utilisation. Le cation lithium induit indépendamment des cascades de transduction du signal (Manji et al., 1995) et l'anion AcAc est labile. Enfin, les études utilisant le d / l-? OHB racémique peuvent être confondues, car seul le stéréoisomère d-? OHB peut être oxydé en AcAc, mais le d-? OHB et le l-? OHB peuvent chacun signaler via GPR109A, inhiber l'inflammasome NLRP3, et servent de substrats lipogéniques.
Corps cétoniques, stress oxydatif et neuroprotection
Le stress oxydatif est généralement défini comme un état dans lequel les ROS sont présentés en excès, en raison d'une production excessive et / ou d'une élimination altérée. Les rôles antioxydants et atténuants du stress oxydatif des corps cétoniques ont été largement décrits à la fois in vitro et in vivo, en particulier dans le contexte de la neuroprotection. Comme la plupart des neurones ne génèrent pas efficacement de phosphates à haute énergie à partir d'acides gras, mais oxydent les corps cétoniques lorsque les glucides sont rares, les effets neuroprotecteurs des corps cétoniques sont particulièrement importants (Cahill GF Jr, 2006; Edmond et al., 1987; Yang et al., 1987). Dans les modèles de stress oxydatif, l'induction du BDH1 et la suppression du SCOT suggèrent que le métabolisme du corps cétonique peut être reprogrammé pour maintenir divers signaux cellulaires, potentiel redox ou besoins métaboliques (Nagao et al., 2016; Tieu et al., 2003).
Les corps cétoniques diminuent les degrés de dommages cellulaires, de blessures, de décès et diminuent l'apoptose dans les neurones et les cardiomyocytes (Haces et al., 2008 ; Maalouf et al., 2007 ; Nagao et al., 2016 ; Tieu et al., 2003). Les mécanismes invoqués sont variés et pas toujours linéairement liés à la concentration. De faibles concentrations millimolaires de (d ou l)-?OHB récupèrent les ROS (anion hydroxyle), tandis que l'AcAc récupère de nombreuses espèces de ROS, mais uniquement à des concentrations qui dépassent la plage physiologique (IC50 20–67 mM) (Haces et al., 2008) . A l'inverse, une influence bénéfique sur le potentiel redox de la chaîne de transport d'électrons est un mécanisme couramment lié au d-?OHB. Alors que les trois corps cétoniques (d/l-?OHB et AcAc) réduisaient la mort des cellules neuronales et l'accumulation de ROS déclenchée par l'inhibition chimique de la glycolyse, seuls le d-?OHB et l'AcAc empêchaient le déclin de l'ATP neuronal. Inversement, dans un modèle hypoglycémique in vivo, (d ou l)-?OHB, mais pas AcAc, a empêché la peroxydation lipidique de l'hippocampe (Haces et al., 2008 ; Maalouf et al., 2007 ; Marosi et al., 2016 ; Murphy, 2009 ; Tieu et al., 2003). Des études in vivo sur des souris nourries avec un régime cétogène (87 % de graisses kcal et 13 % de protéines) ont montré une variation neuroanatomique de la capacité antioxydante (Ziegler et al., 2003), où les changements les plus profonds ont été observés dans l'hippocampe, avec une augmentation de la glutathion peroxydase et du total capacités antioxydantes.
Le régime cétogène, les esters cétoniques (voir aussi Utilisation thérapeutique du régime cétogène et des corps cétoniques exogènes) ou l'administration de ?OHB exercent une neuroprotection dans les modèles d'AVC ischémique (Rahman et al., 2014) ; la maladie de Parkinson (Tieu et al., 2003) ; crise de toxicité de l'oxygène du système nerveux central (D'Agostino et al., 2013); spasmes épileptiques (Yum et al., 2015); le syndrome d'encéphalomyopathie mitochondriale, d'acidose lactique et d'épisodes de type AVC (MELAS) (Frey et al., 2016) et la maladie d'Alzheimer (Cunnane et Crawford, 2003 ; Yin et al., 2016). À l'inverse, un rapport récent a démontré des preuves histopathologiques de la progression neurodégénérative par un régime cétogène dans un modèle de souris transgénique de réparation anormale de l'ADN mitochondrial, malgré l'augmentation de la biogenèse mitochondriale et des signatures antioxydantes (Lauritzen et al., 2016). D'autres rapports contradictoires suggèrent que l'exposition à des concentrations élevées de corps cétoniques provoque un stress oxydatif. Des doses élevées de ?OHB ou d'AcAc ont induit une sécrétion d'oxyde nitrique, une peroxydation lipidique, une expression réduite de SOD, de glutathion peroxydase et de catalase dans les hépatocytes de veau, tandis que dans les hépatocytes de rat, l'induction de la voie MAPK a été attribuée à AcAc mais pas à ?OHB (Abdelmegeed et al., 2004 ; Shi et al., 2014 ; Shi et al., 2016).
Pris ensemble, la plupart des rapports lient? OHB à l'atténuation du stress oxydatif, car son administration inhibe la production de ROS / superoxyde, prévient la peroxydation lipidique et l'oxydation des protéines, augmente les niveaux de protéines antioxydantes et améliore la respiration mitochondriale et la production d'ATP (Abdelmegeed et al., 2004; Haces et al., 2008; Jain et al., 1998; Jain et al., 2002; Kanikarla-Marie et Jain, 2015; Maalouf et al., 2007; Maalouf et Rho, 2008; Marosi et al., 2016; Tieu et al., 2003; Yin et al., 2016; Ziegler et al., 2003). Bien que l'AcAc ait été plus directement corrélée que l'OHB à l'induction du stress oxydatif, ces effets ne sont pas toujours facilement disséqués des réponses pro-inflammatoires prospectives (Jain et al., 2002; Kanikarla-Marie et Jain, 2015; Kanikarla-Marie et Jain, 2016). En outre, il est essentiel de considérer que le bénéfice antioxydant apparent conféré par les régimes cétogènes pléiotropiques peut ne pas être transduit par les corps cétoniques eux-mêmes, et la neuroprotection conférée par les corps cétoniques peut ne pas être entièrement attribuable au stress oxydatif. Par exemple, pendant la privation de glucose, dans un modèle de privation de glucose dans les neurones corticaux,? OHB a stimulé le flux autophagique et empêché l'accumulation d'autophagosomes, qui était associée à une diminution de la mort neuronale (Camberos-Luna et al., 2016). Le d-? OHB induit également les protéines antioxydantes canoniques FOXO3a, SOD, MnSOD et catalase, de manière prospective par inhibition de l'HDAC (Nagao et al., 2016; Shimazu et al., 2013).
Foie gras non alcoolique (NAFLD) et métabolisme du corps cétonique
La NAFLD associée à l'obésité et la stéatohépatite non alcoolique (NASH) sont les causes les plus courantes de maladie du foie dans les pays occidentaux (Rinella et Sanyal, 2016), et l'insuffisance hépatique induite par la NASH est l'une des raisons les plus courantes de transplantation hépatique. Alors que le stockage excessif de triacylglycérols dans les hépatocytes> 5% du poids du foie (NAFL) seul ne provoque pas de fonction hépatique dégénérative, la progression vers la NAFLD chez l'homme est en corrélation avec une résistance systémique à l'insuline et un risque accru de diabète de type 2, et peut contribuer à la pathogenèse de les maladies cardiovasculaires et les maladies rénales chroniques (Fabbrini et al., 2009; Targher et al., 2010; Targher et Byrne, 2013). Les mécanismes pathogènes de la NAFLD et de la NASH sont incomplètement compris mais incluent des anomalies du métabolisme hépatocytaire, l'autophagie hépatocytaire et le stress du réticulum endoplasmique, la fonction des cellules immunitaires hépatiques, l'inflammation du tissu adipeux et les médiateurs inflammatoires systémiques (Fabbrini et al., 2009; Masuoka et Chalasani, 2013) ; Targher et al., 2010; Yang et al., 2010). Des perturbations du métabolisme des glucides, des lipides et des acides aminés se produisent et contribuent à l'obésité, au diabète et à la NAFLD chez l'homme et dans les organismes modèles [examiné dans (Farese et al., 2012; Lin et Accili, 2011; Newgard, 2012; Samuel et Shulman, 2012; Sun et Lazar, 2013)]. Alors que des anomalies hépatocytaires dans le métabolisme des lipides cytoplasmiques sont couramment observées dans la NAFLD (Fabbrini et al., 2010b), le rôle du métabolisme mitochondrial, qui régit l'élimination oxydative des graisses, est moins clair dans la pathogenèse de la NAFLD. Des anomalies du métabolisme mitochondrial surviennent et contribuent à la pathogenèse de la NAFLD / NASH (Hyotylainen et al., 2016; Serviddio et al., 2011; Serviddio et al., 2008; Wei et al., 2008). Il est général (Felig et al., 1974; Iozzo et al., 2010; Koliaki et al., 2015; Satapati et al., 2015; Satapati et al., 2012; Sunny et al., 2011) mais pas uniforme ( Koliaki et Roden, 2013; Perry et al., 2016; Rector et al., 2010) consensus selon lequel, avant le développement de la NASH de bonne foi, l'oxydation mitochondriale hépatique, et en particulier l'oxydation des graisses, est augmentée dans l'obésité, la résistance systémique à l'insuline et NAFLD. Il est probable qu'à mesure que la NAFLD progresse, l'hétérogénéité de la capacité oxydative, même parmi les mitochondries individuelles, émerge, et finalement la fonction oxydative devient altérée (Koliaki et al., 2015; Rector et al., 2010; Satapati et al., 2008; Satapati et al. ., 2012).
La cétogenèse est souvent utilisée comme indicateur de l'oxydation des graisses hépatiques. Des altérations de la cétogenèse apparaissent à mesure que la NAFLD progresse dans des modèles animaux, et probablement chez l'homme. Par des mécanismes incomplètement définis, l'hyperinsulinémie supprime la cétogenèse, contribuant peut-être à l'hypocétonémie par rapport aux témoins maigres (Bergman et al., 2007 ; Bickerton et al., 2008 ; Satapati et al., 2012 ; Soeters et al., 2009 ; Sunny et al. , 2011 ; Vice et al., 2005). Néanmoins, la capacité des concentrations de corps cétoniques circulants à prédire la NAFLD est controversée (Männistö et al., 2015 ; Sanyal et al., 2001). Des méthodes spectroscopiques quantitatives robustes de résonance magnétique dans des modèles animaux ont révélé une augmentation du taux de renouvellement des cétones avec une résistance modérée à l'insuline, mais une diminution des taux était évidente avec une résistance à l'insuline plus sévère (Satapati et al., 2012 ; Sunny et al., 2010). Chez les humains obèses atteints de stéatose hépatique, le taux cétogène est normal (Bickerton et al., 2008; Sunny et al., 2011) et, par conséquent, les taux de cétogenèse sont diminués par rapport à l'augmentation de la charge en acides gras dans les hépatocytes. Par conséquent, l'acétyl-CoA dérivé de l'a-oxydation peut être dirigé vers l'oxydation terminale dans le cycle TCA, augmentant l'oxydation terminale, la gluconéogenèse induite par le phosphoénolpyruvate via l'anaplérose/cataplerose et le stress oxydatif. L'acétyl-CoA est également éventuellement exporté des mitochondries sous forme de citrate, un substrat précurseur de la lipogenèse (Fig. 4) (Satapati et al., 2015 ; Satapati et al., 2012 ; Solinas et al., 2015). Alors que la cétogenèse devient moins sensible à l'insuline ou au jeûne avec une obésité prolongée (Satapati et al., 2012), les mécanismes sous-jacents et les conséquences en aval de cela restent incomplètement compris. Des preuves récentes indiquent que mTORC1 supprime la cétogenèse d'une manière qui peut être en aval de la signalisation de l'insuline (Kucejova et al., 2016), ce qui est concordant avec les observations selon lesquelles mTORC1 inhibe l'induction de Hmgcs2 médiée par PPAR? (Sengupta et al., 2010) ( voir aussi Réglementation HMGCS2 et SCOT/OXCT1).

Les observations préliminaires de notre groupe suggèrent des conséquences hépatiques néfastes d'une insuffisance cétogène (Cotter et al., 2014). Pour vérifier l'hypothèse selon laquelle une altération de la cétogenèse, même dans des états saturés en glucides et donc «non cétogènes», contribue à un métabolisme anormal du glucose et provoque une stéatohépatite, nous avons généré un modèle murin d'insuffisance cétogène marquée par l'administration d'oligonucléotides antisens ciblés Hmgcs2. La perte de HMGCS2 chez des souris adultes standard à faible teneur en matière grasse a provoqué une hyperglycémie modérée et une augmentation marquée de la production de centaines de métabolites hépatiques, parmi lesquels une suite suggérant fortement l'activation de la lipogenèse. L'alimentation riche en graisses des souris dont la cétogenèse est insuffisante a entraîné des lésions et une inflammation importantes des hépatocytes. Ces résultats corroborent les hypothèses centrales selon lesquelles (i) la cétogenèse n'est pas une voie de débordement passive, mais plutôt un nœud dynamique de l'homéostasie physiologique hépatique et intégrée, et (ii) une augmentation cétogénique prudente pour atténuer la NAFLD / NASH et un métabolisme désordonné du glucose hépatique méritant d'être exploré. .
Comment une cétogenèse altérée pourrait-elle contribuer à une lésion hépatique et à une altération de l'homéostasie du glucose? La première considération est de savoir si le coupable est une carence en flux cétogène ou en cétones elles-mêmes. Un rapport récent suggère que les corps cétoniques peuvent atténuer les lésions hépatiques induites par le stress oxydatif en réponse aux acides gras polyinsaturés n-3 (Pawlak et al., 2015). Rappelez-vous qu'en raison du manque d'expression SCOT dans les hépatocytes, les corps cétoniques ne sont pas oxydés, mais ils peuvent contribuer à la lipogenèse et remplir divers rôles de signalisation indépendamment de leur oxydation (voir également Destins métaboliques non oxydants des corps cétoniques et? OHB comme un médiateur de signalisation). Il est également possible que les corps cétoniques dérivés d'hépatocytes puissent servir de signal et / ou de métabolite pour les types cellulaires voisins dans l'acinus hépatique, y compris les cellules étoilées et les macrophages cellulaires de Kupffer. Alors que la littérature limitée disponible suggère que les macrophages sont incapables d'oxyder les corps cétoniques, cela n'a été mesuré qu'en utilisant des méthodologies classiques, et seulement dans les macrophages péritonéaux (Newsholme et al., 1986; Newsholme et al., 1987), indiquant qu'une re l'évaluation est appropriée étant donné l'expression abondante de SCOT dans les macrophages dérivés de la moelle osseuse (Youm et al., 2015).
Le flux cétogène des hépatocytes peut également être cytoprotecteur. Bien que les mécanismes bénéfiques puissent ne pas dépendre de la cétogenèse en soi, des régimes cétogènes à faible teneur en glucides ont été associés à une amélioration de la NAFLD (Browning et al., 2011; Foster et al., 2010; Kani et al., 2014; Schugar et Crawford, 2012) . Nos observations indiquent que la cétogenèse des hépatocytes peut rétroagir et réguler le flux du cycle du TCA, le flux anaplérotique, la gluconéogenèse dérivée du phosphoénolpyruvate (Cotter et al., 2014) et même le renouvellement du glycogène. L'atteinte cétogène oblige l'acétyl-CoA à augmenter le flux de TCA, ce qui dans le foie a été associé à une lésion accrue liée aux ROS (Satapati et al., 2015; Satapati et al., 2012); force le détournement de carbone vers des espèces lipidiques synthétisées de novo qui pourraient se révéler cytotoxiques; et empêche la réoxydation du NADH en NAD + (Cotter et al., 2014) (Fig. 4). Prises ensemble, des expériences futures sont nécessaires pour examiner les mécanismes par lesquels une insuffisance cétogène relative peut devenir inadaptée, contribuer à l'hyperglycémie, provoquer une stéatohépatite et déterminer si ces mécanismes sont actifs dans la NAFLD / NASH humaine. Comme les preuves épidémiologiques suggèrent une altération de la cétogenèse au cours de la progression de la stéatohépatite (Embade et al., 2016; Marinou et al., 2011; Männistö et al., 2015; Pramfalk et al., 2015; Safaei et al., 2016), la cétogenèse hépatique pourrait s'avérer salutaire (Degirolamo et al., 2016; Honda et al., 2016).
Corps cétoniques et insuffisance cardiaque (HF)
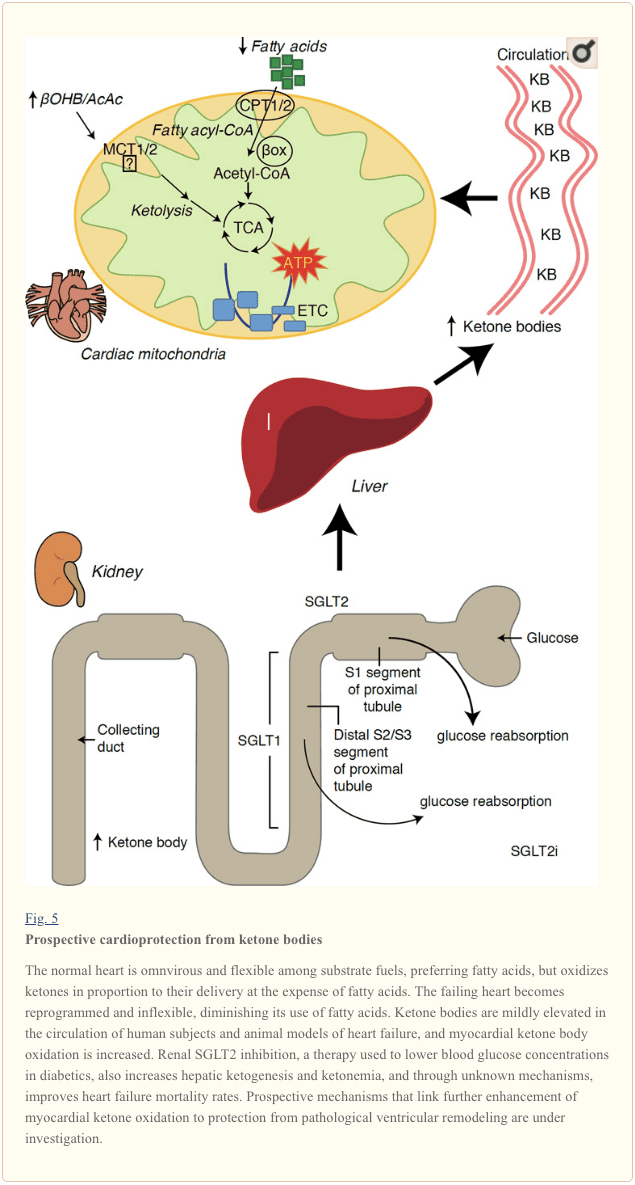
Avec un taux métabolique supérieur à 400 kcal / kg / jour et un chiffre d’affaires de 6 – 35 kg ATP / jour, le cœur est l’organe avec la dépense énergétique et la demande en oxydation les plus élevées (Ashrafian et al., 2007; Wang et al., 2010b). La grande majorité du volume d'énergie myocardique provient des mitochondries et 70% de cette quantité provient de la FAO. Le cœur est omnivore et souple dans des conditions normales, mais le cœur qui se remodèle pathologiquement (par exemple en raison d’hypertension ou d’infarctus du myocarde) et le cœur diabétique deviennent métaboliquement inflexibles (Balasse et Fery, 1989; BING, 1954; Fukao et al., 2004 ; Lopaschuk et al., 2010; Taegtmeyer et al., 1980; Taegtmeyer et al., 2002; Young et al., 2002). En effet, des anomalies génétiquement programmées du métabolisme du carburant cardiaque dans des modèles murins provoquent une cardiomyopathie (Carley et al., 2014; Neubauer, 2007). Dans des conditions physiologiques, les coeurs normaux oxydent les corps cétoniques proportionnellement à leur libération, aux dépens de l'oxydation des acides gras et du glucose, et le myocarde est le plus gros consommateur de corps cétoniques par unité de masse (BING, 1954; Crawford et coll., 2009; GARLAND et al. ., 1962; Hasselbaink et coll., 2003; Jeffrey et coll., 1995; Pelletier et coll., 2007; Tardif et coll., 2001; Yan et coll., 2009). Comparés à l'oxydation des acides gras, les corps cétoniques sont plus efficaces sur le plan énergétique, générant plus d'énergie disponible pour la synthèse d'ATP par molécule d'oxygène investi (rapport P / O) (Kashiwaya et al., 2010; Sato et al., 1995; Veech, 2004) . L'oxydation des corps cétoniques fournit également une énergie potentiellement plus élevée que la FAO, en maintenant l'ubiquinone oxydée, ce qui augmente la durée d'oxydoréduction dans la chaîne de transport d'électrons et libère de l'énergie pour synthétiser l'ATP (Sato et al., 1995; Veech, 2004). L'oxydation des corps cétoniques peut également limiter la production de ROS et donc le stress oxydatif (Veech, 2004).
Des études préliminaires d'intervention et d'observation indiquent un rôle salutaire potentiel des corps cétoniques dans le cœur. Dans le contexte expérimental des lésions d'ischémie / reperfusion, les corps cétoniques ont conféré des effets cardioprotecteurs potentiels (Al-Zaid et al., 2007; Wang et al., 2008), probablement en raison de l'augmentation de l'abondance mitochondriale du cœur ou de la régulation à la hausse d'une phosphorylation oxydante cruciale. médiateurs (Snorek et al., 2012; Zou et al., 2002). Des études récentes indiquent que l'utilisation de corps cétoniques est augmentée dans les cœurs défaillants de souris (Aubert et al., 2016) et d'humains (Bedi et al., 2016), ce qui corrobore des observations antérieures chez l'homme (BING, 1954; Fukao et al., 2000; Janardhan et al., 2011; Longo et al., 2004; Rudolph et Schinz, 1973; Tildon et Cornblath, 1972). Les concentrations circulantes dans le corps cétonique sont augmentées chez les patients insuffisants cardiaques, en proportion directe des pressions de remplissage, observations dont le mécanisme et la signification restent inconnus (Kupari et coll., 1995; Lommi et coll., 1996; Lommi et coll., 1997, Neely et coll. ., 1972), mais les souris présentant un déficit sélectif en SCOT en cardiomyocytes présentent un remodelage ventriculaire pathologique accéléré et des signatures ROS en réponse à une lésion de surcharge de pression induite chirurgicalement (Schugar et al., 2014).
Des observations intéressantes récentes dans le traitement du diabète ont révélé un lien potentiel entre le métabolisme de la cétone du myocarde et le remodelage ventriculaire pathologique (Fig. 5). L'inhibition du co-transporteur 2 (SGLT2i) tubulaire sodique / glucose proximal proximal augmente les concentrations circulantes dans le corps cétonique chez l'homme (Ferrannini et coll., 2016a; Inagaki et coll., 2015) et les souris (Suzuki et coll., 2014) cétogenèse hépatique (Ferrannini et al., 2014; Ferrannini et al., 2016a; Katz et Leiter, 2015; Mudaliar et al., 2015). De manière frappante, au moins un de ces agents a diminué le nombre d'hospitalisations liées à l'HF (comme le révèle l'étude EMPA-REG OUTCOME) et amélioré la mortalité cardiovasculaire (Fitchett et coll., 2016; Sonesson et coll., 2016; Wu et coll., 2016a ; Zinman et al., 2015). Bien que les mécanismes moteurs à l'origine des effets bénéfiques d'HF sur SGLT2i lié restent activement discutés, le bénéfice en termes de survie est probablement multifactoriel, incluant potentiellement une cétose, mais également des effets bénéfiques sur le poids, la tension artérielle, les taux de glucose et d'acide urique, la rigidité artérielle, le système nerveux sympathique, diurèse / diminution du volume plasmatique et augmentation de l'hématocrite (Raz et Cahn, 2016; Vallon et Thomson, 2016). Pris dans son ensemble, l’idée que la cétonémie augmentant le traitement soit chez les patients HF, soit chez ceux présentant un risque élevé de développer une HF, reste controversée, mais fait actuellement l’objet d’enquêtes précliniques et cliniques (Ferrannini et al., 2016b; Kolwicz et al., 2008). 2016; Lopaschuk et Verma, 2016; Mudaliar et al., 2016; Taegtmeyer, 2016).
Les corps cétoniques dans la biologie du cancer
Les liens entre les corps cétoniques et le cancer apparaissent rapidement, mais des études menées à la fois sur des modèles animaux et sur des êtres humains ont abouti à diverses conclusions. Le métabolisme des cétones étant dynamique et sensible à l'état des nutriments, il est intéressant de rechercher des connexions biologiques au cancer en raison du potentiel des thérapies nutritionnelles guidées avec précision. Les cellules cancéreuses subissent une reprogrammation métabolique afin de maintenir une prolifération et une croissance cellulaires rapides (DeNicola et Cantley, 2015; Pavlova et Thompson, 2016). L’effet classique de Warburg sur le métabolisme des cellules cancéreuses découle du rôle dominant de la glycolyse et de la fermentation de l’acide lactique dans le transfert d’énergie et la compensation d’une dépendance moindre à la phosphorylation oxydative et à la respiration mitochondriale limitée (De Feyter et al., 2016; Grabacka et al., 2016; Kang et al., 2015; Poff et al., 2014; Shukla et al., 2014). Le glucose carbone est principalement dirigé par la glycolyse, la voie du pentose phosphate et la lipogenèse, qui fournissent ensemble les intermédiaires nécessaires à l’expansion de la biomasse tumorale (Grabacka et al., 2016; Shukla et al., 2014; Yoshii et al., 2015). L'adaptation des cellules cancéreuses à la privation de glucose résulte de leur capacité à exploiter d'autres sources de carburant, notamment l'acétate, la glutamine et l'aspartate (Jaworski et coll., 2016; Sullivan et coll., 2015). Par exemple, l'accès restreint au pyruvate révèle la capacité des cellules cancéreuses à convertir la glutamine en acétyl-CoA par carboxylation, en maintenant les besoins énergétiques et anaboliques (Yang et al., 2014). Une adaptation intéressante des cellules cancéreuses est l'utilisation de l'acétate en tant que carburant (Comerford et al., 2014; Jaworski et al., 2016; Mashimo et al., 2014; Wright et Simone, 2016; Yoshii et al., 2015). L'acétate est également un substrat pour la lipogenèse, essentielle à la prolifération des cellules tumorales, et le gain de ce conduit lipogénique est associé à une survie plus courte du patient et à une charge tumorale plus importante (Comerford et al., 2014; Mashimo et al., 2014; Yoshii et al. ., 2015).
Les cellules non cancéreuses déplacent facilement leur source d'énergie du glucose vers les corps cétoniques pendant la privation de glucose. Cette plasticité peut être plus variable selon les types de cellules cancéreuses, mais les tumeurs cérébrales implantées in vivo ont oxydé le [2,4-13C2]-?OHB à un degré similaire au tissu cérébral environnant (De Feyter et al., 2016). Les modèles « effet Warburg inverse » ou « métabolisme tumoral à deux compartiments » émettent l'hypothèse que les cellules cancéreuses induisent la production d'?OHB dans les fibroblastes adjacents, fournissant les besoins énergétiques de la cellule tumorale (Bonuccelli et al., 2010 ; Martinez-Outschoorn et al., 2012). Dans le foie, un passage des hépatocytes de la cétogenèse à l'oxydation des cétones dans les cellules de carcinome hépatocellulaire (hépatome) est cohérent avec l'activation des activités BDH1 et SCOT observée dans deux lignées cellulaires d'hépatome (Zhang et al., 1989). En effet, les cellules d'hépatome expriment OXCT1 et BDH1 et oxydent les cétones, mais uniquement lorsqu'elles manquent de sérum (Huang et al., 2016). Alternativement, la cétogenèse des cellules tumorales a également été proposée. Des changements dynamiques dans l'expression des gènes cétogènes sont présentés lors de la transformation cancéreuse de l'épithélium colique, un type de cellule qui exprime normalement HMGCS2, et un rapport récent a suggéré que HMGCS2 pourrait être un marqueur pronostique de mauvais pronostic dans les carcinomes colorectaux et épidermoïdes (Camarero et al., 2006 ; Chen et al., 2016). Que cette association nécessite ou implique la cétogenèse, ou une fonction de clair de lune de HMGCS2, reste à déterminer. Inversement, la production apparente de ?OHB par les cellules de mélanome et de glioblastome, stimulée par le PPAR? fénofibrate, un agoniste, a été associé à un arrêt de la croissance (Grabacka et al., 2016). D'autres études sont nécessaires pour caractériser les rôles de l'expression de HMGCS2/SCOT, de la cétogenèse et de l'oxydation des cétones dans les cellules cancéreuses.
Au-delà du domaine du métabolisme des carburants, les cétones ont récemment été impliquées dans la biologie des cellules cancéreuses via un mécanisme de signalisation. L'analyse du mélanome BRAF-V600E + a indiqué une induction dépendante de l'OCT1 de HMGCL d'une manière oncogène dépendante de BRAF (Kang et al., 2015). L'augmentation de HMGCL était corrélée à une concentration plus élevée d'AcAc cellulaire, qui à son tour a amélioré l'interaction BRAFV600E-MEK1, amplifiant la signalisation MEK-ERK dans une boucle de réaction qui entraîne la prolifération et la croissance des cellules tumorales. Ces observations soulèvent la question intrigante de la cétogenèse extrahépatique prospective qui prend alors en charge un mécanisme de signalisation (voir également? OHB comme médiateur de signalisation et Controverses dans la cétogenèse extrahépatique). Il est également important de prendre en compte les effets indépendants de l'AcAc, du d-? OHB et de la l-? OHB sur le métabolisme du cancer, et lors de l'examen de HMGCL, le catabolisme de la leucine peut également être dérangé.
Les effets des régimes cétogènes (voir aussi Utilisation thérapeutique du régime cétogène et des corps cétoniques exogènes) dans les modèles animaux cancéreux sont variés (De Feyter et al., 2016 ; Klement et al., 2016 ; Meidenbauer et al., 2015 ; Poff et al. ., 2014 ; Seyfried et al., 2011 ; Shukla et al., 2014). Alors que les associations épidémiologiques entre l'obésité, le cancer et les régimes cétogènes sont débattues (Liskiewicz et al., 2016; Wright et Simone, 2016), une méta-analyse utilisant des régimes cétogènes dans des modèles animaux et dans des études humaines a suggéré un impact salutaire sur la survie, avec avantages liés de manière prospective à l'ampleur de la cétose, au moment de l'initiation du régime et à l'emplacement de la tumeur (Klement et al., 2016 ; Woolf et al., 2016). Le traitement des cellules cancéreuses pancréatiques avec des corps cétoniques (d-?OHB ou AcAc) a inhibé la croissance, la prolifération et la glycolyse, et un régime cétogène (81 % de graisses kcal, 18 % de protéines, 1 % de glucides) a réduit le poids de la tumeur in vivo, la glycémie et augmentation du poids musculaire et corporel chez les animaux porteurs d'un cancer implanté (Shukla et al., 2014). Des résultats similaires ont été observés en utilisant un modèle cellulaire de glioblastome métastatique chez des souris ayant reçu une supplémentation en cétone dans l'alimentation (Poff et al., 2014). À l'inverse, un régime cétogène (91 % de graisses kcal, 9 % de protéines) a augmenté la concentration circulante d'OHB et diminué la glycémie, mais n'a eu aucun impact sur le volume tumoral ou la durée de survie des rats porteurs de gliome (De Feyter et al., 2016). Un indice de glucose cétone a été proposé comme indicateur clinique qui améliore la gestion métabolique du traitement du cancer du cerveau induit par un régime cétogène chez l'homme et la souris (Meidenbauer et al., 2015). Pris ensemble, les rôles du métabolisme des corps cétoniques et des corps cétoniques dans la biologie du cancer sont alléchants car ils présentent chacun des options thérapeutiques traitables, mais des aspects fondamentaux restent à élucider, avec des influences claires émergeant d'une matrice de variables, y compris (i) les différences entre les cétones exogènes corps versus régime cétogène, (ii) type de cellule cancéreuse, polymorphismes génomiques, grade et stade ; et (iii) le moment et la durée de l'exposition à l'état cétotique.

La cétogenèse est créée par les corps cétoniques par la dégradation des acides gras et des acides aminés cétogènes. Ce processus biochimique fournit de l'énergie à divers organes, notamment le cerveau, dans des situations de jeûne en réponse à une indisponibilité de la glycémie. Les corps cétoniques sont principalement produits dans les mitochondries des cellules du foie. Alors que d'autres cellules sont capables de mener à bien la cétogenèse, elles ne sont pas aussi efficaces que les cellules du foie. Comme la cétogenèse se produit dans la mitochondrie, ses processus sont régulés indépendamment.
Dr. Alex Jimenez DC, CCST Insight
Application thérapeutique du régime cétogène et des corps cétoniques exogènes
Les applications des régimes cétogènes et des corps cétoniques en tant qu'outils thérapeutiques sont également apparues dans des contextes non cancéreux, notamment l'obésité et la NAFLD / NASH (Browning et coll., 2011; Foster et coll., 2010; Schugar et Crawford, 2012); insuffisance cardiaque (Huynh, 2016; Kolwicz et al., 2016; Taegtmeyer, 2016); maladie neurologique et neurodégénérative (Martin et al., 2016; McNally et Hartman, 2012; Rho, 2015; Rogawski et al., 2016; Yang et Cheng, 2010; Yao et al., 2011); erreurs innées du métabolisme (Scholl-Bürgi et al, 2015); et la performance physique (Cox et al., 2016). L’efficacité des régimes cétogènes a été particulièrement appréciée dans le traitement des crises épileptiques, en particulier chez les patients pharmacorésistants. La plupart des études ont évalué les régimes cétogènes chez les patients pédiatriques et ont révélé une réduction jusqu’à ~ 50 de la fréquence des crises convulsives après les mois 3, avec une efficacité améliorée dans certains syndromes (Wu et al., 2016b). L'expérience est plus limitée dans l'épilepsie adulte, mais une réduction similaire est évidente, avec une meilleure réponse chez les patients symptomatiques souffrant d'épilepsie généralisée (Nei et al., 2014). Les mécanismes anticonvulsifs sous-jacents demeurent incertains, bien que les hypothèses émises incluent une utilisation réduite du glucose / glycolyse, un transport reprogrammé du glutamate, un impact indirect sur le canal potassique sensible au ATP ou le récepteur adénosine A1, une Lambrechts et al., 2016; Lin et al., 2017; Lutas et Yellen, 2013). On ignore si l'effet anticonvulsivant est principalement attribuable aux corps cétoniques ou aux conséquences métaboliques en cascade d'une alimentation à faible teneur en glucides. Néanmoins, les esters cétoniques (voir ci-dessous) semblent élever le seuil de crises dans les modèles animaux de crises provoquées (Ciarlone et coll., 2016; D'Agostino et coll., 2013; Viggiano et coll., 2015).
Les régimes faibles en glucides de type Atkins et cétogènes sont souvent jugés désagréables et peuvent provoquer constipation, hyperuricémie, hypocalcémie, hypomagnésémie, conduire à la néphrolithiase, à l’acidocétose, provoquer une hyperglycémie et augmenter le cholestérol circulant ainsi que les concentrations en acides gras libres (Bisschop et al., 2001) ; Kossoff et Hartman, 2012; Kwiterovich et al., 2003; Suzuki et al., 2002). Pour ces raisons, l’adhésion à long terme pose des problèmes. Les études sur les rongeurs utilisent couramment une distribution de macronutriments distincte (94% kcal lipides, 1% kcal glucides, 5% kcal protéines, Bio-Serv F3666), ce qui provoque une forte cétose. Cependant, l'augmentation de la teneur en protéines, même jusqu'à 10% kcal, diminue considérablement la cétose, et la restriction en protéines 5% kcal confère des effets métaboliques et physiologiques confondants. Cette formule alimentaire est également appauvrie en choline, une autre variable qui influe sur la susceptibilité aux lésions hépatiques et même à la cétogenèse (Garbow et coll., 2011; Jornayvaz et coll., 2010; Kennedy et coll., 2007; Pissios et coll., 2013; Schugar. et al., 2013). Les effets de la consommation à long terme de régimes cétogènes chez la souris restent mal définis, mais des études récentes chez la souris ont révélé une survie normale et l'absence de marqueurs d'atteinte hépatique chez la souris sous régime cétogène tout au long de leur vie, bien que le métabolisme des acides aminés, la dépense énergétique et la signalisation de l'insuline ont été nettement reprogrammés (Douris et al., 2015).
Les mécanismes qui augmentent la cétose par le biais de mécanismes alternatifs aux régimes cétogènes comprennent l'utilisation de précurseurs du corps cétoniques pouvant être ingérés. L'administration de corps cétoniques exogènes pourrait créer un état physiologique unique, non retrouvé dans la physiologie normale, car les concentrations de glucose et d'insuline en circulation sont relativement normales, alors que les cellules pourraient épargner l'absorption et l'utilisation de glucose. Les corps cétoniques eux-mêmes ont des demi-vies courtes et l'ingestion ou l'infusion de sel de sodium-OHB pour obtenir une cétose thérapeutique provoque une charge de sodium indésirable. Le R / S-1,3-butanediol est un dialcool non toxique qui est facilement oxydé dans le foie pour donner du d / l-ß OHB (Desrochers et al., 1992). Dans des contextes expérimentaux distincts, cette dose a été administrée quotidiennement à des souris ou à des rats pendant sept semaines, produisant des concentrations circulantes d'OHB allant jusqu'à 5 mM dans les 2 h suivant l'administration, qui est stable pendant au moins 3 h supplémentaires (D ' Agostino et al., 2013). Une suppression partielle de la prise alimentaire a été observée chez des rongeurs ayant reçu du R / S-1,3-butanediol (Carpenter et Grossman, 1983). De plus, trois esters cétoniques (KE) chimiquement distincts, (i) monoester de R-1,3-butanediol et de d-ß OHB (R-3-hydroxybutyl R-A OHB); (ii) glycéryl-tris-OHB; et (iii) le diester d'acétoacétate de R, S-1,3-butanediol, ont également été largement étudiés (Brunengraber, 1997; Clarke et al., 2012a; Clarke et al., 2012b; Desrochers et al., 1995a; Desrochers et al., 1995a; Desrochers et al. ., 2010b; Kashiwaya et al., XNUMX). Un avantage inhérent du premier est que 2 moles de d-? OHB physiologique sont produites par mole de KE, après l'hydrolyse de l'estérase dans l'intestin ou le foie. L'innocuité, la pharmacocinétique et la tolérance ont été les plus étudiées chez les humains ingérant du R-3-hydroxybutyl R-? OHB, à des doses allant jusqu'à 714 mg / kg, donnant des concentrations circulantes de d-? OHB allant jusqu'à 6 mM (Clarke et al., 2012a; Cox et al., 2016; Kemper et al., 2015; Shivva et al., 2016). Chez les rongeurs, cette KE diminue l'apport calorique et le cholestérol total plasmatique, stimule le tissu adipeux brun et améliore la résistance à l'insuline (Kashiwaya et al., 2010; Kemper et al., 2015; Veech, 2013). Des découvertes récentes indiquent que pendant l'exercice chez des athlètes entraînés, l'ingestion de R-3-hydroxybutyl R-? OHB a diminué la glycolyse du muscle squelettique et les concentrations plasmatiques de lactate, augmenté l'oxydation intramusculaire du triacylglycérol et préservé la teneur en glycogène musculaire, même lorsque les glucides co-ingérés stimulaient la sécrétion d'insuline ( Cox et al., 2016). Il est nécessaire de développer plus avant ces résultats intrigants, car l’amélioration de la performance lors des exercices d’endurance est principalement due à une réponse robuste à la KE chez les sujets 2 / 8. Néanmoins, ces résultats appuient les études classiques indiquant une préférence pour l'oxydation des cétones par rapport aux autres substrats (GARLAND et coll., 1962; Hasselbaink et coll., 2003; Stanley et coll., 2003; Valente-Silva et coll., 2015). y compris pendant l'exercice, et que les athlètes entraînés pourraient être mieux préparés à utiliser des cétones (Johnson et coll., 1969a; Johnson et Walton, 1972; Winder et coll., 1974; Winder et coll., 1975). Enfin, les mécanismes susceptibles d’améliorer les performances physiques après un apport calorique égal (réparti de manière différentielle entre les macronutriments) et un taux de consommation d’oxygène égal restent à déterminer.
Perspective future
Jadis largement stigmatisée comme une voie de débordement capable d’accumuler des émissions toxiques provenant de la combustion des graisses dans des états restreints en glucides (le paradigme «cétotoxique»), des observations récentes confirment l’idée que le métabolisme du corps cétonique joue un rôle salutaire même dans les états saturés en glucides, ouvrant ainsi la voie à un «cétohormétique». ' hypothèse. Alors que les approches nutritionnelles et pharmacologiques faciles pour manipuler le métabolisme de la cétone en font une cible thérapeutique attrayante, des expériences agressives mais prudentes restent à la fois dans les laboratoires de recherche fondamentale et translationnelle. Des besoins non satisfaits sont apparus dans les domaines de la définition du rôle du métabolisme de la cétone dans l'insuffisance cardiaque, l'obésité, la NAFLD / NASH, le diabète de type 2 et le cancer. La portée et l’impact des rôles de signalisation «non canoniques» des corps cétoniques, y compris la régulation des PTM qui alimentent probablement en amont les voies métaboliques et de signalisation, nécessitent une exploration plus approfondie. Enfin, la cétogenèse extrahépatique pourrait ouvrir des mécanismes de signalisation paracrine et autocrine intrigants et des opportunités d’influencer le co-métabolisme dans le système nerveux et les tumeurs afin d’atteindre des objectifs thérapeutiques.
Remerciements
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
Notes
En conclusion, les corps cétoniques sont créés par le foie pour être utilisés comme source d'énergie lorsqu'il n'y a pas assez de glucose disponible dans le corps humain. La cétogenèse se produit lorsque le taux de glucose dans le sang est faible, en particulier après que les autres réserves de glucides cellulaires ont été épuisées. Le but de l'article ci-dessus était de discuter des rôles multidimensionnels des corps cétoniques dans le métabolisme du carburant, la signalisation et la thérapeutique. La portée de nos informations est limitée aux problèmes de chiropratique et de santé de la colonne vertébrale. Pour discuter du sujet, n'hésitez pas à demander à M. Jimenez ou à nous contacter à 915-850-0900 .
Organisé par le Dr. Alex Jimenez
Référencé de: Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

Sujet de discussion supplémentaire: maux de dos aigus
Mal au dos est l’une des causes les plus fréquentes d’invalidité et de journées d’absence dans le monde du travail. Les douleurs dorsales sont la deuxième raison en importance des visites chez le médecin, dépassées en nombre seulement par les infections des voies respiratoires supérieures. Environ 80 pour cent de la population aura mal au dos au moins une fois dans sa vie. La colonne vertébrale est une structure complexe composée d'os, d'articulations, de ligaments et de muscles, entre autres tissus mous. Blessures et / ou conditions aggravées, telles que hernies discales, peut éventuellement conduire à des symptômes de maux de dos. Les blessures sportives ou les accidents d'automobile sont souvent la cause la plus fréquente de maux de dos. Cependant, les mouvements les plus simples peuvent parfois avoir des conséquences douloureuses. Heureusement, les options de traitement alternatives, telles que les soins chiropratiques, peuvent aider à soulager les maux de dos grâce à l'utilisation des ajustements de la colonne vertébrale et des manipulations manuelles, en fin de compte améliorer le soulagement de la douleur.

EXTRA EXTRA | SUJET IMPORTANT: Chiropraticien recommandé à El Paso, TX?
Déni de responsabilité
Champ d'exercice professionnel *
Les informations présentes sur "Rôles Multi-Dimensionnels Des Corps De Cétones Dans Le Métabolisme Du Carburant, La Signalisation Et La Thérapeutique" n'est pas destiné à remplacer une relation individuelle avec un professionnel de la santé qualifié ou un médecin agréé et ne constitue pas un avis médical. Nous vous encourageons à prendre des décisions en matière de soins de santé en fonction de vos recherches et de votre partenariat avec un professionnel de la santé qualifié.
Informations sur le blog et discussions sur la portée
Notre périmètre d'information se limite à la chiropratique, à l'appareil locomoteur, acupuncture, médecines physiques, bien-être, contribution étiologique troubles viscérosomatiques dans les présentations cliniques, la dynamique clinique du réflexe somatoviscéral associé, les complexes de subluxation, les problèmes de santé sensibles et/ou les articles, sujets et discussions sur la médecine fonctionnelle.
Nous fournissons et présentons collaboration clinique avec des spécialistes de diverses disciplines. Chaque spécialiste est régi par son champ d'exercice professionnel et sa juridiction de délivrance de permis. Nous utilisons des protocoles de santé et de bien-être fonctionnels pour traiter et soutenir les soins des blessures ou des troubles du système musculo-squelettique.
Nos vidéos, messages, sujets, sujets et idées couvrent des questions cliniques, des problèmes et des sujets qui se rapportent à et soutiennent directement ou indirectement notre champ de pratique clinique.*
Notre bureau a raisonnablement tenté de fournir des citations à l’appui et a identifié les études de recherche pertinentes à l’appui de nos publications. Nous fournissons des copies des études de recherche à l'appui disponibles aux organismes de réglementation et au public sur demande.
Nous comprenons que nous couvrons les questions qui nécessitent une explication supplémentaire de la façon dont cela peut aider dans un plan de soins ou un protocole de traitement particulier ; Par conséquent, pour discuter plus en détail du sujet ci-dessus, n'hésitez pas à demander Dr Alex Jimenez, DC, ou contactez-nous au 915-850-0900.
Nous sommes là pour vous aider, vous et votre famille.
Bénédictions
Dr. Alex Jimenez DC MSACP, Infirmière*, CCST, IFMCP*, CIFM*, ATN*
Courriel: coach@elpasofonctionalmedicine.com
Licencié en tant que docteur en chiropratique (DC) en Texas & Nouveau Mexique*
Numéro de licence Texas DC TX5807, Numéro de licence DC du Nouveau-Mexique NM-DC2182
Licence d'infirmière autorisée (RN *) en Floride
Licence de Floride RN Licence # RN9617241 (Numéro de contrôle 3558029)
Statut compact : Licence multi-États: Autorisé à exercer en États 40*
Actuellement immatriculé : ICHS : MSN* FNP (Programme d'infirmières praticiennes familiales)
Dr Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Ma carte de visite numérique


 Encore une fois, nous vous souhaitons la bienvenue¸
Encore une fois, nous vous souhaitons la bienvenue¸
